题目内容
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g)
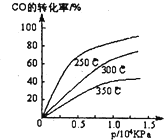
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g)(1)不同温度下的平衡转化率与压强的关系如图所示.
①该反应△H
②实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是
(2)某温度下,将2molCO和6mOlH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=O.1 mol?L-1.
①该反应的平衡常数K=
②在其他条件不变的情况下,将容器体积压缩到原来的
| 1 |
| 2 |
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时
| n(H2) |
| n(CH3OH) |
③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH3OH,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为
分析:(1)①由图象可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,据此判断△H;根据反应前后气体物质的量的变化判断△S;根据△G=△H-T△S判断反应自发性问题;
②由图可知,在250℃、1.3×104kPa左右,CO转化率已较高(达90%左右),增大压强CO转化率提高不大,且生产成本增加;
(2)①利用三段式计算平衡时各组分的平衡浓度,再根据k=
计算;
②增大压强,正、逆反应速率都增大,平衡向正反应方向,平衡时各组分的浓度都增大,据此判断;
③各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可,据此解答a、b的关系;
计算出平衡时CH3OH(g)的物质的量,c大于此值平衡向逆反应进行,按化学计量数转化到左边,得到2mol CO时c的值最大,据此计算解答.
②由图可知,在250℃、1.3×104kPa左右,CO转化率已较高(达90%左右),增大压强CO转化率提高不大,且生产成本增加;
(2)①利用三段式计算平衡时各组分的平衡浓度,再根据k=
| c(CH3OH) |
| c(CO)×c2(H2) |
②增大压强,正、逆反应速率都增大,平衡向正反应方向,平衡时各组分的浓度都增大,据此判断;
③各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可,据此解答a、b的关系;
计算出平衡时CH3OH(g)的物质的量,c大于此值平衡向逆反应进行,按化学计量数转化到左边,得到2mol CO时c的值最大,据此计算解答.
解答:解:(1)①由图象可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;
该反应正反应是气体物质的量减小的反应,故熵减小,即△S<0;
由△G=△H-T△S<0,反应自发进行,可知该反应在低温趋向自发进行,高温下不能自发进行,该反应不一定自发进行,
故答案为:<;<;不一定;
②由图可知,在250℃、1.3×104kPa左右,CO转化率已较高(达90%左右),增大压强CO转化率提高不大,且生产成本增加,故实际生产条件控制在1.3×104kPa左右,
故答案为:该压强下,CO转化率已较高(90%左右),再增大压强CO转化率提高不大,且生产成本增加;
(2)①2molCO和6molH2充入2L的密闭容器中,CO、H2的起始浓度分别为
=1mol/L、
=3mol/L,充分反应后,达到平衡时测得c(CO)=0.1 mol/L,CO浓度变化为1mol/L-0.1mol/L=0.9mol/L,则:
CO(g)+2H2(g)?CH30H(g)
开始(mol/L):1 3 0
变化(mol/L):0.9 1.8 0.9
平衡(mol/L):0.1 1.2 0.9
故该温度下,该反应的平衡常数k=
=6.25,
故答案为:6.25;
②a.增大压强,平衡时氢气的浓度增大,故a错误;
b.增大压强,反应物、生成物的浓度都增大,故正、逆反应速率都加快,故b正确;
c.增大压强平衡向正反应方向移动,甲醇的物质的量增加,故c正确;
d.增大压强平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡时
减小,故d错误,
故答案为:bc;
③各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可,所以有:a+c=2,b+2c=6,整理得b=2+2a;
由①计算可知,平衡时CH3OH的物质的量为0.9mol/L×2L=1.8mol,所以c>1.8mol平衡向逆反应进行.按化学计量数转化到左边,得到2mol CO时c的值最大,所以c最大为2mol.所以1.8<c<≤2,
故答案为:b=2+2a;1.8<c<≤2.
该反应正反应是气体物质的量减小的反应,故熵减小,即△S<0;
由△G=△H-T△S<0,反应自发进行,可知该反应在低温趋向自发进行,高温下不能自发进行,该反应不一定自发进行,
故答案为:<;<;不一定;
②由图可知,在250℃、1.3×104kPa左右,CO转化率已较高(达90%左右),增大压强CO转化率提高不大,且生产成本增加,故实际生产条件控制在1.3×104kPa左右,
故答案为:该压强下,CO转化率已较高(90%左右),再增大压强CO转化率提高不大,且生产成本增加;
(2)①2molCO和6molH2充入2L的密闭容器中,CO、H2的起始浓度分别为
| 2mol |
| 2L |
| 6mol |
| 2L |
CO(g)+2H2(g)?CH30H(g)
开始(mol/L):1 3 0
变化(mol/L):0.9 1.8 0.9
平衡(mol/L):0.1 1.2 0.9
故该温度下,该反应的平衡常数k=
| 0.9 |
| 0.1×1.22 |
故答案为:6.25;
②a.增大压强,平衡时氢气的浓度增大,故a错误;
b.增大压强,反应物、生成物的浓度都增大,故正、逆反应速率都加快,故b正确;
c.增大压强平衡向正反应方向移动,甲醇的物质的量增加,故c正确;
d.增大压强平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡时
| n(H2) |
| n(CH3OH) |
故答案为:bc;
③各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可,所以有:a+c=2,b+2c=6,整理得b=2+2a;
由①计算可知,平衡时CH3OH的物质的量为0.9mol/L×2L=1.8mol,所以c>1.8mol平衡向逆反应进行.按化学计量数转化到左边,得到2mol CO时c的值最大,所以c最大为2mol.所以1.8<c<≤2,
故答案为:b=2+2a;1.8<c<≤2.
点评:本题综合性较大,涉及化学反应自发性判断、化学平衡常数、化学平衡影响因素、等效平衡计算等,(2)③注意等效思想的运用以及运用极限方法确定c的取值范围.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
 CH30H(g)
CH30H(g)
 CH3OH(g)
CH3OH(g)
 CH30H(g)
CH30H(g)
 的情报况如下图所示,请回答:
的情报况如下图所示,请回答: