题目内容
8.将几滴KSCN(SCN-是“类卤离子”,与卤素离子性质相似)溶液加入到硫酸酸化的硫酸铁溶液中,溶液变成红色.向该红色溶液中加入适量氯水,红色褪去.对于该溶液红色褪去的原因,你的猜想是Cl2将SCN-氧化成(SCN)2;请设计一个简单的实验来证明你的猜想:取褪色后的溶液少许于试管中,加入KSCN溶液,若溶液再次变红,则猜想成立.分析 SCN-是“类卤离子”,与卤素离子性质相似,所以SCN-具有还原性,遇氯水发生氧化反应,由此分析解答;
解答 解:SCN-是“类卤离子”,与卤素离子性质相似,所以SCN-具有还原性,遇氯水,氯水具有强氧化性,即Cl2将SCN-氧化成(SCN)2;可以取褪色后的溶液少许于试管中,加入KSCN溶液,观察溶液颜色的变化,
故答案为:Cl2将SCN-氧化成(SCN)2;取褪色后的溶液少许于试管中,加入KSCN溶液,若溶液再次变红,则猜想成立.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握题给信息以及相关物质的性质,难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
17.下列说法正确的是( )
| A. | 某溶液中滴入AgNO3溶液,生成白色沉淀,该溶液中可能含Cl- | |
| B. | 2 molSO2与2 mol O2充分反应可生成2 mol SO3 | |
| C. | 某溶液与淀粉碘化钾溶液反应后出现蓝色,则证明该溶液一定是氯水 | |
| D. | 胶体与其它分散系的本质区别在于胶体具有丁达尔效应 |
19.3717Cl、3517Cl为不同的核素,下列说法正确的是( )
| A. | 37Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 3717Cl、3517Cl互为同位素,3517Cl2与3717Cl2互为同系物 | |
| D. | 常温下,4.48L 3717Cl2含有8NA个中子(NA为阿伏加德罗常数的值) |
16.设NA表示阿伏加德罗常数.下列说法中,错误的是( )
| A. | 标准状况下,22.4 L氢气和氯气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1 mol氦气含有的原子数约为NA | |
| C. | 1 mol Al3+含有核外电子数为3NA | |
| D. | t℃时,1 L pH=6的纯水中,含1×10-6NA个OH- |
13.下列实验操作顺序或方法正确的是( )
| A. | 把苯和浓溴水混合后加入FeBr3可制溴苯 | |
| B. | 浓硫酸与浓硝酸混合冷却后,边滴入苯边振荡,在60℃水浴中加热可制硝基苯 | |
| C. | 乙烷中混有乙烯,通入氢气与乙烯反应可达到除杂的目的 | |
| D. | 乙烯通入水中可制得酒精 |
20.下列试剂:①氯水②纯碱晶体③五氧化二磷④过氧化钠⑤绿矾⑥电石,若它们长期置于敞口的试剂瓶暴露于空气中,由于发生氧化还原反应而变质的是( )
| A. | ①④⑤ | B. | ①②④⑤ | C. | ②④⑥ | D. | ①②③④⑤⑥ |
17.将下列固体物质溶于水,再将其溶液加热、蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
| A. | FeCl3 | B. | NaAlO2 | C. | NaHCO3 | D. | Na2SO3 |
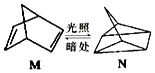 含碳的化合物之间很容易发生转化.请回答下列问题:
含碳的化合物之间很容易发生转化.请回答下列问题: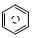 (l)的燃烧热为 3267.5kJ•mol-1,
(l)的燃烧热为 3267.5kJ•mol-1,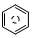 (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)