题目内容
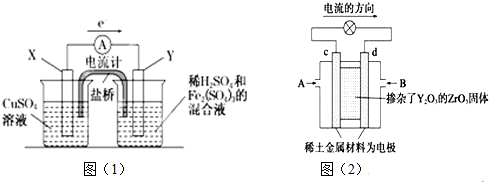
13.锌铜原电池(如图)工作时,下列叙述正确的是( )
| A. | 正极反应为Zn-2e-═Zn2+ | |
| B. | 电池总反应为Zn+Cu2+═Zn2++Cu | |
| C. | 取出盐桥,电流表指针仍然偏转 | |
| D. | 盐桥(填充KCl饱和溶液侵泡的琼脂)中的K+移向ZnSO4溶液 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,溶液中阳离子向正极移动,以此解答该题.
解答 解:A.正极上铜离子得电子,则正极反应为Cu2++2e-=Cu,故A错误;
B.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B正确;
C.取去盐桥,不能形成闭合回路,则不能形成原电池反应,故C错误;
D.溶液中阳离子向正极移动,即K+移向CuSO4溶液,故D错误;
故选B.
点评 本题考查原电池的工作原理,注意把握工作原理以及电极方程式的书写,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
相关题目
5.下列说法中正确的是( )
| A. | 酸性溶液中只存在H+,不存在0H-,只有中性溶液或纯水中既有H+又有OH- | |
| B. | 温度越高,KW越大,所以温度高的溶液中的c(H+)一定比温度低的溶液中的c(H+)大 | |
| C. | 水的电离平衡受酸、碱和温度等条件的影响 | |
| D. | 向水中加人碱时,由于加人的OH-与水电离产生的H+作用.使c(H+)减小,平衡向电离的方向移动. |
1. 如图
如图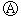 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,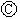 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现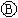 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通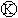 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
 如图
如图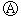 为直流电源,
为直流电源,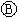 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,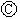 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现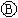 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通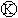 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. |  中电解质溶液为FeCl3 中电解质溶液为FeCl3 | ||
| C. | f电极为锌板 | D. | c极发生的反应为2H++2e-═H2↑ |
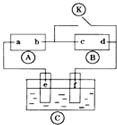
8.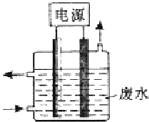 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极附近碱性增强,阳极附近碱性减弱 | |
| D. | 除去CN-的反应:5ClO-+2CN-+2H+═N2↑+2CO2↑+5Cl-+H2O |
18.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L | |
| B. | 常温下pH=1的盐酸溶液中的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA | |
| D. | 11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
5.下列化学用语表示不正确的是( )
| A. | 亚硫酸在溶液中主要的电离方程式:H2SO3?H ++HSO3- | |
| B. | 用铁棒作阳极电解饱和氯化钠溶液的反应:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 热的纯碱溶液可以清洗油污的原因:CO32-+H2O?HCO3-+OH- | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe一2e-═Fe2+. |
2.近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO?N2+CO2.
②上述反应的平衡常数表达式K=$\frac{c({N}_{2}).c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是c.
A.T1>T2 B.T1<T2 C.无法比较
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示:
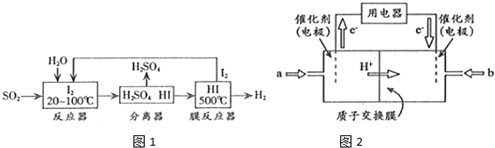
①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表
物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应的平衡常数表达式K=$\frac{c({N}_{2}).c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是c.
A.T1>T2 B.T1<T2 C.无法比较
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示:

①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.