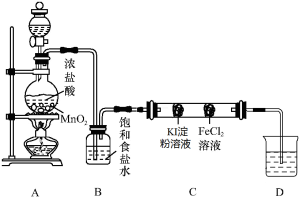
题目内容
【题目】二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等。请回答:
(1)已知2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。

①T1__________(填“>”“<”或“=”)T2,判断的依据是_____________________;该反应为____________(填“放”或“吸”)热反应,判断的依据是___________________。
②下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | a | b | c | d |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b对应的投料比为_____________。
ii.投料比为8:10时,平衡混合气体中SO3体积分数为_________________。
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

①吸收池中发生反应的离子方程式是_____________________。
②电解池的构造示意图如下:

i.在图中标示出b区的Na+和HSO3-的移动方向。
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:__________________。
【答案】(1)①>,相同条件下,温度越高反应速率越快,达到化学平衡的时间越短;放;温度升高时平衡向吸热方向移动,SO2的转化率减小;②i.4:15;ii.50%;
(2)①SO2+SO32-+H2O=2HSO3-;
②i. ;
;
ii.HSO3--2e-+H2O=SO42-+3H+,多出的H+与HSO3-反应生成SO2。
【解析】
试题分析:(1)①影响化学反应速率的因素,升高温度,化学反应速率加快,首先达到平衡,因此T1>T2;根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,根据图像,升高温度SO2的转化率降低,说明正反应方向为放热反应;②i:四种投料比转化成2:18、2:15、2、2:22/7、2:5/2,根据勒夏特列原理,增大O2的浓度,平衡向正反应方向移动,SO2的转化率增大,因此b符合投料比为4:15;ii:投料比为8:10时,SO2的转化率为90.0%,2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始: 8 10 0
变化: 8×90.0% 4×90.0% 8×90.0%
平衡:8-8×90.0% 10-4×90.0% 8×90.0%
反应后的总物质的量为8-8×90.0%+10-4×90.0%+8×90.0%=14.4mol,则SO3%=8×90.0%/14.4×100%=50%;(2)①根据流程图,以及SO2的性质,因此吸收池中发生的离子反应有SO2+SO32-+H2O=HSO3-;②i:a区是阴极,阳离子放电,其电极反应式:2H++2e-=H2↑,为了平衡溶液电中性,Na+向a区移动,c区是阳极,阴离子放电,H2O+HSO3--2e-=SO42-+3H+,为了平衡电中性,HSO3-向阳极移动,因此图是: ;ii:根据i的分析,H+会和HSO3-发生,产生SO2。
;ii:根据i的分析,H+会和HSO3-发生,产生SO2。

【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备。工业上制备AlC13溶液用图示流程(已知A1C13易升华)。
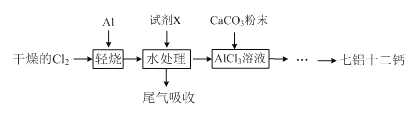
(1)轻烧后的气体用水处理前导气管为何要保温?
(2)用水处理添加的试剂X是 ,其目的是 。
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是 。用氨水沉淀、过滤后的滤液主要成分是 。
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, 。(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
补全实验步骤: 冰水洗涤,干燥,得到CaC12·2H2O。