题目内容
【题目】银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如图: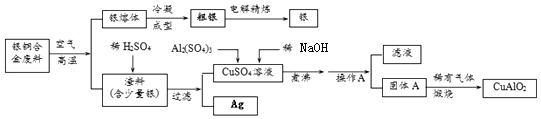
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式: .
(2)固体混合物A的组成为、 .
(3)操作A的名称为 .
(4)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为mol CuAlO2 , 至少需要1.0molL﹣1的Al2(SO4)3溶液 L.
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是、、过滤、干燥.
【答案】
(1)CuO+H2SO4=CuSO4+H2O
(2)Al(OH)3,CuO
(3)过滤
(4)50,25
(5)蒸发浓缩,冷却结晶
【解析】解:(1)渣料含有CuO,与稀硫酸反应生成硫酸铜和水,反应的化学方程式为CuO+H2SO4=CuSO4+H2O,
故答案为:CuO+H2SO4=CuSO4+H2O;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知A为Al(OH)3和CuO,
故答案为:Al(OH)3;CuO;
(3)操作A用于分离固体和液体,为过滤操作,
故答案为:过滤;
(4)m(Cu)=64%×5.0kg=3.2Kg=3200g,
n(Cu)=m÷M=3200g÷64g/mol=50mol,
则理论上5.0kg废料中的铜可完全转化为50mol CuAlO2,
由于在CuAlO2中Cu、Al个数比为1:1,
所以根据原子守恒可得:n[Al2(SO4)3]= ![]() n(Al)=
n(Al)= ![]() n(Cu)=25mol,
n(Cu)=25mol,
n= ![]() =25L,
=25L,
故答案为:50;25;
(5)由CuSO4溶液获得CuSO45H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤,洗涤和低温干燥等操作,
故答案为:蒸发浓缩、冷却结晶.
银铜合金在空气中熔炼,渣料中含有氧化铜和少量银,加入稀硫酸,过滤后得到硫酸铜溶液,在硫酸铜溶液中加入硫酸铝和稀氢氧化钠溶液,煮沸、过滤得到Al(OH)3和CuO,煅烧可得到CuAlO2,滤渣含有Ag,粗银电解时,粗银为阳极,在阴极上得到银,可得到提纯的目的,
(1)根据渣料中含有与稀硫酸反应的CuO,据此书写化学方程式;
(2)Cu(OH)2开始分解的温度为80℃,煮沸后Cu(OH)2分解产生氧化铜;
(3)分离固体和液体的操作是过滤;
(4)m(Cu)=64%×5.0kg=3.2Kg=3200g,在CuAlO2中Cu、Al个数比为1:1,以此计算该题;
(5)由CuSO4溶液获得CuSO45H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤,洗涤和低温干燥等操作.

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.气体的压强不再改变
(2)表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 .
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:
CO | H2 | CH3OH |
0.5molL﹣1 | 2molL﹣1 | 6molL﹣1 |
此时反应的正、逆反应速率的关系是:v(正)v(逆)(填“>”“<”或“═”).



