题目内容
【题目】CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________,其中未成对电子数为____________。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________。ZnGeAs2中Zn、Ge、As的电负性从大到小的顺序为________________。
(3)聚吡咯的单体为吡咯(![]() ),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
立方碳化硅 | 晶体硅 | 金刚石 | |
熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:__________________________________________________。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。
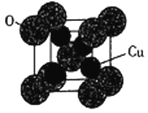
①氧化亚铜属于__________晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3(列出计算式即可)。
【答案】 [Ar]3d54s1 6 As>Ge>Ga As>Ge>Zn sp3 5∶1 它们都是具有正四面休形空间网状结构的原子晶体,结合力为共价键,由于键长C-C<c-si<si-si,键能c-c>C-Si>Si-Si,故熔点:金刚石>立方碳化硅>晶体硅</c-si<si-si,键能c-c> 离子 ![]() ×107
×107
【解析】试题分析:(1)基态铬原子的核外有24个电子,根据能量最低等原则排布核外电子; 3d54s1都是未成对电子;(2)同周期元素从左到右第一电离能逐渐增大;非金属性越强电负性越大;(3) 氮原子的价电子对数![]() ;单键为σ键、双键中一个是σ键一个是π键;(4) 熔点:金刚石>立方碳化硅>晶体硅;它们都是原子晶体,结合力为共价键,键长C-C<C-Si<Si-Si;(5)根据氧化亚铜的熔点为1235℃分析其晶体类型;②根据均摊原则计算晶胞中亚铜离子、氧离子数,根据a=425.8pm计算1mol晶胞的体积,根据
;单键为σ键、双键中一个是σ键一个是π键;(4) 熔点:金刚石>立方碳化硅>晶体硅;它们都是原子晶体,结合力为共价键,键长C-C<C-Si<Si-Si;(5)根据氧化亚铜的熔点为1235℃分析其晶体类型;②根据均摊原则计算晶胞中亚铜离子、氧离子数,根据a=425.8pm计算1mol晶胞的体积,根据![]() 计算密度。
计算密度。
解析:(1)基态铬原子的核外有24个电子,核外电子排布式为[Ar]3d54s1;3d54s1都是未成对电子,所以未成对电子数是6;(2) 同周期元素从左到右第一电离能逐渐增大,所以Ge、Ga、As的第一电离能从大到小的顺序为As>Ge>Ga;非金属性越强电负性越大,所以Zn、Ge、As 电负性从大到小的顺序为As>Ge>Zn;(3) 氮原子的价电子对数![]() ,所以氮原子的杂化轨道类型为sp3;单键为σ键、双键中一个是σ键一个是π键,所以吡咯分子中σ键与π键的数目之比为10:2=5:1;(4)它们都是具有正四面休形空间网状结构的原子晶体,结合力为共价键,由于键长C-C<C-Si<Si-Si,键能C-C>C-Si>Si-Si,所以熔点:金刚石>立方碳化硅>晶体硅;(5) ①根据氧化亚铜的熔点为1235℃,比原子晶体低,比分子晶体高,氧化亚铜属于离子晶体;②根据均摊原则,晶胞中亚铜离子数是4、氧离子数是
,所以氮原子的杂化轨道类型为sp3;单键为σ键、双键中一个是σ键一个是π键,所以吡咯分子中σ键与π键的数目之比为10:2=5:1;(4)它们都是具有正四面休形空间网状结构的原子晶体,结合力为共价键,由于键长C-C<C-Si<Si-Si,键能C-C>C-Si>Si-Si,所以熔点:金刚石>立方碳化硅>晶体硅;(5) ①根据氧化亚铜的熔点为1235℃,比原子晶体低,比分子晶体高,氧化亚铜属于离子晶体;②根据均摊原则,晶胞中亚铜离子数是4、氧离子数是![]() ,所以晶胞的摩尔质量是288g/mol, a=425.8pm,晶胞的体积为
,所以晶胞的摩尔质量是288g/mol, a=425.8pm,晶胞的体积为![]() ,
, ![]() =
=![]()
![]() ×107 g·cm-3。
×107 g·cm-3。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案