题目内容
18.现有三组实验,①分离汽油和氯化钠溶液 ②分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合溶液 ③用酒精浸泡中草药提取其中的有效成分,操作正确的是( )| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
分析 ①汽油不溶于水,与氯化钠溶液分层;
②二者互溶,但沸点不同;
③中草药中的有效成分可溶于酒精.
解答 解:①汽油不溶于水,与氯化钠溶液分层,则选择分液法分离;
②二者互溶,但沸点不同,则选择蒸馏法分离;
③中草药中的有效成分可溶于酒精,为萃取法,
故选C.
点评 本题考查物质分离、提纯方法的选择和应用,为高频考点,把握物质的性质及分离提纯方法为解答的关键,侧重萃取、分液、蒸馏应用的考查,题目难度不大.

练习册系列答案
相关题目
8.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Z元素的核电荷数为X与Y元素核电荷数之和.下列说法正确的是( )
| X | Y | |
| Z | W | |
| T |
| A. | 氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键 | |
| B. | XY2、XW2、ZY2熔沸点依次增大,都是由共价键形成的分子晶体 | |
| C. | 一定条件下,X单质能与ZY2反应生成Z单质,说明X的非金属性比Z强 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,钠能与T形成Na2T2化合物 |
13.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:CrO42-$→_{转换}^{H+}$Cr2O72- $→_{还原}^{Fe_{2}+}$Cr3+$→_{沉淀}^{OH-}$Cr(OH)3↓ 己知转化过程中的反应为:2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2O72-.下列说法不正确的是( )
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
10.下列各组离子能在呈酸性的无色溶液中大量共存的是( )
| A. | Ba2+、Na+、NO3-、MnO4- | B. | Mg2+、Cl-、Al3+、SO42- | ||
| C. | K+、OH-、HCO3-、NO3- | D. | K+、Na+、Fe3+、SO32- |
8.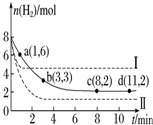 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )| A. | 0.5mol•L-1•min-1. | B. | 0.1mol•L-1•min-1 | ||
| C. | 0 mol•L-1•min-1 | D. | 0.125mol•L-1•min-1 |

 .
.