题目内容
11.下表为元素周期表的一部分,期中的编号代表对应的元素
请回答下列问题:
(1)表中属于ds区的元素是⑩(填编号).
(2)写出元素⑨的高价离子的电子排布式1s22s22p63s23p63d5.
(3)某元素的最外层电子排布式为nsnnpn+1,该元素原子的核外共有7种不同运动状态的电子.该元素在周期表中的位置是上表中相对应的④(填编号).
(4)⑥、⑦分别①形成的化合物稳定性较强的为HCl(化学式表示)
分析 由元素在周期表的位置可知,①是H,②是Be,③是B,④是N,⑤是Al,⑥是S,⑦是Cl,⑧是Ca,⑨是Fe,⑩为Cu.
(1)只有Cu的价电子为3d104s1;
(2)⑨是Fe元素,最高价离子是Fe3+,核外有23个电子;
(3)s轨道最多只能排2个电子,所以n=2,最外层电子排布式为nsnnpn+1,则该元素的最外层是2s22p3,该元素是N元素;
(4)⑥、⑦分别是S、Cl元素,①是H元素,非金属性越强,对应氢化物越稳定.
解答 解:由元素在周期表的位置可知,①是H,②是Be,③是B,④是N,⑤是Al,⑥是S,⑦是Cl,⑧是Ca,⑨是Fe,⑩为Cu.
(1)元素周期表中位于ds区的元素是第一、二副族元素,Cu的价电子为3d104s1,所以⑩位于ds区,故答案为:⑩;
(2)⑨是Fe元素,最高价离子是Fe3+,核外有23个电子,排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(3)s轨道最多只能排2个电子,所以n=2,最外层电子排布式为nsnnpn+1,则该元素的最外层是2s22p3,该元素是N元素,核外有7个电子,就有7种不同的运动状态;是上表中的④,故答案为:7;④;
(4)⑥、⑦分别是S、Cl元素,①是H元素,Cl的非金属性比S强,所以HCl比较稳定,故答案为:HCl.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、原子结构与性质为解答的关键,侧重分析与应用能力的考查,注意电子排布及元素的位置的关系,题目难度不大.

练习册系列答案
相关题目
2. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
3.下列说法中错误的是( )
| A. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| B. | 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀 | |
| C. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| D. | 二氧化硫漂白过的草帽过一段时间后变黄 |
20.下列化学用语正确的是( )
| A. | 原子核内有8个中子的氧原子:18O | B. | Na2O的电子式: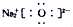 | ||
| C. | HClO 的结构式:H一CI一O | D. | F一的结构示意图: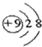 |
1.下列气体既能用NaOH固体干燥,又能用浓硫酸干燥的是( )
| A. | SO2 | B. | N2 | C. | CO2 | D. | NH3 |
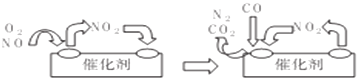
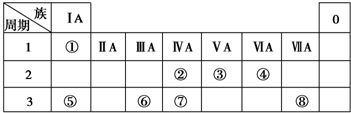
 →
→
 .
. .
.