题目内容
5.已知2H2(g)+O2(g)═2H2O(l)△H=-569.6kJ/mol,2H2O(g)═2H2(g)+O2(g)△H=+482.1kJ/mol.现有1g液态H2O,蒸发时吸收的热量是( )| A. | 2.43 kJ | B. | 4.86 kJ | C. | 43.8 kJ | D. | 87.5 kJ |
分析 ①2H2(g)+O2(g)═2H2O(l);△H=-569.6kJ•mol-1,
②2H2O(g)═2H2(g)+O2(g);△H=+482.1kJ•mol-1.
根据盖斯定律,②+①得2H2O(g)═2H2O(l);△H=-87.5kJ•mol-1,进行计算.
解答 解:已知:①2H2(g)+O2(g)═2H2O(l);△H=-569.6kJ•mol-1,
②2H2O(g)═2H2(g)+O2(g);△H=+482.1kJ•mol-1.
根据盖斯定律,②+①得2H2O(g)═2H2O(l);△H=-87.5kJ•mol-1,
所以2H2O(l)═2H2O(g);△H=+87.5kJ•mol-1,
36g 87.5kJ
1g Q
Q=$\frac{1}{36}$×87.5kJ=2.43kJ.
即1g液态H2O,蒸发时吸收的热量是2.43kJ.
故选:A.
点评 考查盖斯定律的运用,难度不大,注意反应热KJ/mol不是对反应物而言,不是指每摩尔反应物可以放出或吸收多少千焦,而是对整个反应而言,是指按照所给的化学反应式的计量系数完成反应时,每摩尔反应所产生的热效应.

练习册系列答案
相关题目
16.下列离子方程式错误的是( )
| A. | 硫酸氢钠溶液中加入氢氧化钠溶液:H++OH-=H2O | |
| B. | 氧化铜和稀盐酸:CuO+2H+=Cu2++H2O | |
| C. | 少量的NaHCO3与足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 少量的NaHCO3溶液与足量的Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
13.以石墨为电极,电解1L CuSO4和NaCl的混合溶液,其中CuSO4与NaCl的物质的量之和为0.2mol,CuSO4的物质的量占总物质的量的比值为a.下列说法正确的是( )
| A. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体只有氯气 | |
| B. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体的物质的量为0.1mol | |
| C. | 若a=0.2,当Cl-在阳极恰好全部逸出时,产生0.08mol的NaOH | |
| D. | 若电解一段时间后,阴、阳两极产生的气体的物质的量恰好均为0.16mol,则a=0.2 |
20.下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状) | 酸的浓度及体积 | 反应温度 | |
| A | Mg 0.1g | 18.4mol•L-1硫酸10mL | 80℃ |
| B | Mg 0.1g | 1.5mol•L-1盐酸10mL | 60℃ |
| C | Fe 0.1g | 1mol•L-1盐酸 10mL | 60℃ |
| D | Mg 0.1g | 1mol•L-1硫酸10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
17.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、[Al(OH)4]? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SCN? | |
| D. | 加入铝粉能放出氢气的溶液中能大量存在K+、Ba2+、Cl-、Br- |
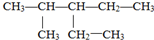 的名称是2-甲基-3-乙基戊烷;
的名称是2-甲基-3-乙基戊烷;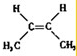 ;
;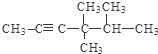 .
. 的系统名称为3-甲基-2-乙基丙苯.
的系统名称为3-甲基-2-乙基丙苯.