题目内容
17.如图1为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:(1)已知②的一种核素中子数为8,则其气态氢化物的摩尔质量为18g/mol.
(2)①②⑤⑥的原子半径由大到小的顺序为Na>Al>C>H(填元素符号);
⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3 (填化学式).
(3)②的单质与③的最高价氧化物对应水化物的浓溶液能发生反应,其反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④形成,X与Y 的反应是潜水艇和呼吸面具中氧气的来源.Y中含有的化学键类型是共价键;X的电子式是
 ;
;(5)某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图2装置来一次性完成的②、⑦非金属性强弱比较的实验研究;甲同学设计实验的依据是强酸制弱酸;其中装置B中所盛试剂的作用为除去CO2中的HCl气体;C中反应的离子方程式为SiO32-+CO2+H2O═H2SiO3↓+CO32-;

分析 根据元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)②为C元素,其中子数为8的核素的质量数为14,其氢化物为甲烷,摩尔质量为18g/mol;
(2)电子层越多,原子半径越大,据此判断①②⑤⑥的原子半径;非金属性越强,最高价氧化物对应的水化物酸性越强,据此判断⑦⑧⑨的最高价含氧酸的酸性大小;
(3)②的单质为C,③的最高价氧化物对应水化物的浓溶液为浓硝酸,碳与浓硝酸在加热条件下反应生成二氧化碳、二氧化氮和水;
(4)X为Na2O2,Y为CO2,二氧化碳为共价化合物,分子中含有共价键;过氧化钠为离子化合物,分子中含有钠离子和过氧根离子;
(5)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图2装置来一次性完成C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;B的作用是除去二氧化碳中氯化氢,C中二氧化碳和硅酸钠反应.
解答 解:由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)②为C元素,中子数为8的C的质量数为:6+8=14,其氢化物为甲烷,该甲烷的摩尔质量为18g/mol,故答案为:18g/mol;
(2)①为H,②为C,⑤为Na,⑥为Al,电子层越多,原子半径越大,则四种原子的原子半径大小为:Na>Al>C>H;
⑦为Si,⑧为S,⑨为Cl,非金属性越强,最高价氧化物对应的水化物酸性越强,非金属性:Cl>S>Si,则酸性大小为:HClO4>H2SO4>H2SiO3,
故答案为:Na>Al>C>H; HClO4>H2SO4>H2SiO3;
(3)②的单质为C,③的最高价氧化物对应水化物的浓溶液为浓硝酸,二者在加热条件下反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)X为Na2O2,Y为CO2,二氧化碳为共价化合物,分子中含有共价键;过氧化钠为离子化合物,钠离子直接用离子符号表示,过氧根离子需要标出最外层电子及所带电荷,过氧化钠的电子式为: ,
,
故答案为:共价键; ;
;
(5)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图2装置来一次性完成同主族元素非金属性强弱比较的实验研究,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应;A装置用来制取二氧化碳,故A为碳酸钙,盐酸易挥发,故B的作用是除去二氧化碳中氯化氢,故B为饱和碳酸钠溶液,C为硅酸钠溶液,二氧化碳和硅酸钠发生反应离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-;
故答案为:强酸制弱酸;除去二氧化碳中氯化氢气体;SiO32-+CO2+H2O═H2SiO3↓+CO32-.
点评 本题考查了元素周期律和元素周期律的综合应用、性质实验方案的设计等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,注意熟练掌握元素周期表结构、元素周期律的内容及性质实验方案的设计原则.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种含氧酸 |
| A. | 铜和浓硝酸反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| B. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氢氧化铜溶于硝酸:2H++Cu(OH)2=Cu2++2H2O | |
| D. | 氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
| A. | 熔点:CO2>KCl>SiO2 | |
| B. | 酸性:HClO4>H2SO4>H3PO4 | |
| C. | 与同浓度的稀盐酸反应剧烈程度:Mg>Al | |
| D. | 热稳定性:HF>H2O>NH3 |
| A. | H2O、Al2Cl6 | B. | CO2、SO42- | ||
| C. | PCl5、[Co(NH3)4Cl2]Cl | D. | NH4Cl、[Cu(NH3)4]SO4 |
| A. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | HF、HCl、H2S、PH3的稳定性依次增强 |
| A. | 盐酸 | B. | CH3COONH4 | C. | CH3COOH | D. | CI2 |
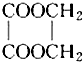 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
| A. | ②③①⑤④ | B. | ②③⑤④① | C. | ②③⑤①④ | D. | ②③⑤①⑥ |