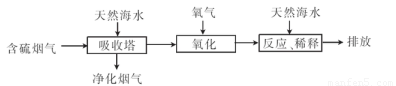
题目内容
下列物质中可以吸收硫酸厂排出的废气中的SO2,防止环境污染的是( )A.NaOH(aq) B.氨水
C.Na2SO4(aq) D.明矾溶液
答案:AB
解析:
解析:
| 解析:碱性溶液能够吸收SO2;中性溶液也能吸收少量SO2,但吸收不彻底;酸性溶液不能吸收SO2.工业上常用NaOH(aq)和氨水吸收SO2.
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是