题目内容
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
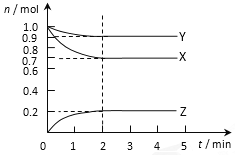
(1) 该反应的化学方程式为:_________________。
(2) 反应开始至2min,用Z表示的平均反应速率为:_________________。
(3) 在下列事实中,什么因素影响了化学反应的速率?
①同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:__________;
②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体:_____________。
(4) 在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g)![]() 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率____________;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率____________。
【答案】 3X + Y![]() 2Z 0.05 mol·L-1·min-1 反应物的性质 催化剂 增大 不变
2Z 0.05 mol·L-1·min-1 反应物的性质 催化剂 增大 不变
【解析】(1)根据图像可知X和Y的物质的量减少,属于反应物。Z的物质的量增加,属于生成物,2min时物质的量不再发生变化,达到平衡状态,此时消耗X和Y分别是1mol-0.7mol=0.3mol、1mol-0.9mol=0.1mol,生成Z是0.2mol,根据变化量之比是相应的化学计量数之比可知该反应的化学方程式为3X + Y![]() 2Z。(2) 反应开始至2min,用Z表示的平均反应速率为
2Z。(2) 反应开始至2min,用Z表示的平均反应速率为![]() =0.05 mol·L-1·min-1。(3)①铁和镁的金属性不同,影响反应速率的因素是反应物的性质;②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体,这说明二氧化锰是催化剂;(4)①升高温度,反应速率加快;②保持容器体积不变,充入不参加反应的惰性气体,反应物浓度不变,反应速率不变。
=0.05 mol·L-1·min-1。(3)①铁和镁的金属性不同,影响反应速率的因素是反应物的性质;②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体,这说明二氧化锰是催化剂;(4)①升高温度,反应速率加快;②保持容器体积不变,充入不参加反应的惰性气体,反应物浓度不变,反应速率不变。





