题目内容
5.下列说法正确的是( )| A. | NaCl固体中含有共价键 | |
| B. | CO2分子中含有离子键 | |
| C. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳的三种核素 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子数 |
分析 A.NaCl为离子化合物,只含有离子键;
B.CO2为共价化合物;
C.为相同元素,但质量数不同;
D.根据质量数=质子数+中子数判断.
解答 解:A.NaCl只含有离子键,不含共价键,故A错误;
B.CO2为共价化合物,不含离子键,故B错误;
C.${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C为相同元素,但质量数不同,属于不同核素,故C正确;
D.${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同质子数,但质量数不同,则中子数分别为8、9、10,故D错误.
故选C.
点评 本题考查较为综合,涉及共价键、离子键、核素以及原子构成等知识,为高频考点,侧重于基本概念的理解和运用的考查,注意把握离子键和共价键的区别,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是( )

| A. | 该氧化物是含有非极性键的离子化合物 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该晶体晶胞结构与CsCl相似 | |
| D. | 晶体中Ba2+的配位数为8 |
16.氮化铝(AlN、Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.下列叙述正确的是( )
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | AlN的摩尔质量为41 g | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | 上述反应中,每生成1 mol AlN需转移3 mol电子 |
20.下表是不同温度下水的离子积常数:
?试回答以下问题:
(1)若25<T1<T2,则a>1×10-14 (填“>”、“<”或“=”),做此判断的理由是水的电离吸热,温度升高,水的电离程度增大,所以水的离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是a+b=14.
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
(1)若25<T1<T2,则a>1×10-14 (填“>”、“<”或“=”),做此判断的理由是水的电离吸热,温度升高,水的电离程度增大,所以水的离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是a+b=14.
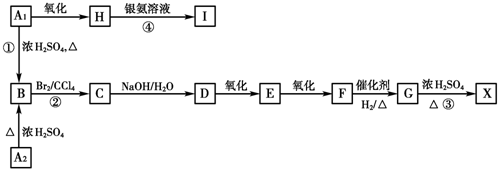
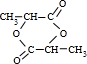 .
.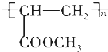 .
.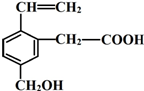 某有机物的结构简式如图,该物质可能有的化学性质是( )
某有机物的结构简式如图,该物质可能有的化学性质是( )