题目内容
下图所示装置中,Fe腐蚀由快到慢的顺序为

[ ]
A.⑤>④>③>②>①
B.⑤>④>①>②>③
C.⑤>③>④>①>②
D.①>②>④>③>⑤
B.⑤>④>①>②>③
C.⑤>③>④>①>②
D.①>②>④>③>⑤
B

练习册系列答案
相关题目
新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α—Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
(1)甲同学用下图所示装置进行α-Fe粉与水蒸气的反应。

证明实验中有氢气产生的现象是 。
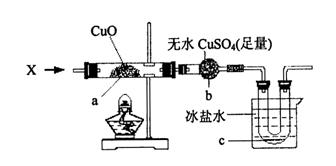
(2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。

①试管a中的物质是 。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
|
实验步骤 |
实验操作 |
实验现象 |
|
Ⅰ |
将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 |
黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
|
Ⅱ |
向实验I中得到的溶液滴加几滴KSCN溶液,振荡 |
溶液没有出现红色 |
实验现象不能确定是否存在Fe3O4,主要原因是
(用离子方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为 mol。