题目内容
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如图:
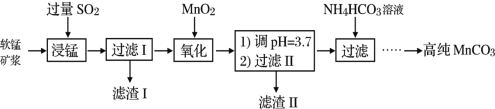
(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有___(写一条。)
(2)浸锰过程中Fe2O3与SO2反应的化学方程式为:Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
(3)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___(填离子符号)。
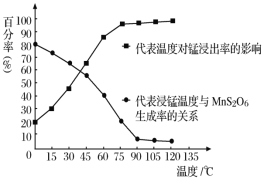
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___。
(5)写出“氧化”过程中MnO2与SO2反应的化学方程式___。
(6)滤渣Ⅱ是___(填化学式)。
(7)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___。
【答案】搅拌或适当升高温度 2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+ Mn2+、Fe2+ 90℃ MnO2+SO2=MnSO4 Fe(OH)3 防止NH4HCO3受热分解,提高原料利用率
+4H+ Mn2+、Fe2+ 90℃ MnO2+SO2=MnSO4 Fe(OH)3 防止NH4HCO3受热分解,提高原料利用率
【解析】
由流程可知软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,SiO2不反应,过滤,滤渣I为SiO2,滤液含有Mn2+、Fe2+,加入MnO2氧化亚铁离子,反应为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体。
(1)可以通过搅拌或者适当升高温度,以提高“浸锰”过程中原料的浸出率。
(2)根据浸锰过程中Fe2O3与SO2反应的总化学方程式Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O和该反应的第一步反应Fe2O3+6H+=2Fe3++3H2O,两方程式相减可得到反应ⅱ的离子方程式2Fe3++SO2+2H2O=2Fe2++SO
+H2O和该反应的第一步反应Fe2O3+6H+=2Fe3++3H2O,两方程式相减可得到反应ⅱ的离子方程式2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+。
+4H+。
(3)软锰矿形成矿浆,通入足量的SO2,MnO2、Fe2O3与SO2反应生成Mn2+、Fe2+,SiO2不反应,过滤,故滤液含有Mn2+、Fe2+。
(4)由图可知,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃。
(5)综上分析,MnO2与SO2反应的化学方程式为MnO2+SO2=MnSO4。
(6)为除去滤液中的铁离子,调节pH,沉淀铁离子,将铁离子转化为氢氧化铁,最后过滤,故滤渣II为氢氧化铁。
(7)NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | R | |||||||||||||||||
B | C | D | E | F | T | |||||||||||||
G | H | I | J | K | L | |||||||||||||
M | N | O | ||||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X高温下反应的化学方程式______。
(2)D的简单气态氢化物的VSEPR模型的名称为______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数=______。
(4)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是______(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______。
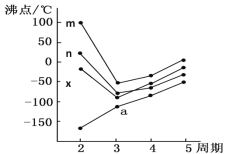
(5)如图四条折线分别表示ⅣA族、Ⅴ/span>A族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是______(填m、n、x或y)。