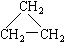
题目内容
6.为了测定一种气态烃A的分子式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气.学生甲、乙设计了两个方案,均认为根据自己的方案能求出A的实验式.他们测得的有关数据如下(箭头表示气流的方向,实验前系统内的空气已排尽):甲:燃烧产物$\stackrel{浓H_{2}SO_{4}}{→}$浓H2SO4增重2.52g$\underset{\stackrel{2.52g}{→}}{18g•mo{l}^{-1}}$增重1.32g$\stackrel{点燃}{→}$生成CO2 1.76g
乙:燃烧产物$\stackrel{碱石灰}{→}$增重5.60g$\stackrel{灼烧CuO}{→}$增重0.64g$\stackrel{石灰水}{→}$增重4g
试完成下列问题:
(1)你认为甲同学方案正确;乙同学方案不正确(填正确、不正确)
(2)请根据你选择的方案,通过计算求出A的实验式.
(3)若要确定A的分子式,是否需要测定其他数据?说明原因.
分析 (1)甲中浓硫酸吸收的是水、碱石灰吸收的是二氧化碳,最终CO燃烧生成二氧化碳,可以根据二者计算H、C原子个数比;
乙中碱石灰吸收水和二氧化碳,CO还原CuO得到二氧化碳,但不能根据碱石灰增加的质量计算出C、H原子个数比;
(2)浓硫酸吸收水的物质的量=$\frac{2.52g}{18g/mol}$=0.14mol,碱石灰吸收二氧化碳的物质的量=$\frac{1.32g}{44g/mol}$=0.03mol,CO燃烧生成二氧化碳物质的量=$\frac{1.76g}{44g/mol}$=0.04mol,则二氧化碳分子个数和水中H原子个数之比为0.07mol:0.028mol=1:4,根据C、H原子个数比判断;
(3)C、H原子个数被1:4,每个C原子最多形成4个C-H键.
解答 解:(1)甲中浓硫酸吸收的是水、碱石灰吸收的是二氧化碳,最终CO燃烧生成二氧化碳,可以根据水的物质的量、二氧化碳的物质的量计算H、C原子个数比,从而确定该物质化学式;
乙中碱石灰吸收水和二氧化碳,剩余的CO还原CuO得到二氧化碳,但不能根据碱石灰增加的质量计算出C、H原子个数比,所以乙不能确定该物质的最简式;
则甲可以求出A的最简式、乙不能求出A的最简式,
故答案为:正确;不正确;
(2)浓硫酸吸收水的物质的量=$\frac{2.52g}{18g/mol}$=0.14mol,碱石灰吸收二氧化碳的物质的量=$\frac{1.32g}{44g/mol}$=0.03mol,CO燃烧生成二氧化碳物质的量=$\frac{1.76g}{44g/mol}$=0.04mol,则二氧化碳分子个数和水中H原子个数之比为0.07mol:0.028mol=1:4,其实验式为CH4,
答:A的实验式为CH4;
(3)C、H原子个数被1:4,每个C原子最多形成4个C-H键,最简式中,H的含量已经达到最大值,所以不用测定其它数据,
答:否; 因为最简式中,H的含量已经达到最大值.
点评 本题考查有机物推断,明确浓硫酸、碱石灰的性质是解本题关键,知道有机物中C原子成键特点,题目难度不大.

| A. | NH4+、Ba2+、Br-、CO32- | B. | Fe3+、Na+、NO3-、SCN- | ||
| C. | Al3+、NO3-、I-、SO42- | D. | Al3+、Cl-、SO42-、HCO3- |
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: | |
| B. | 丙烯制备聚丙烯: | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+NaOH→CH2BrCOONa+H2O | |
| D. | 苯酚钠溶液通入少量的CO2: -O-+CO2+H2O -O-+CO2+H2O -OH+HCO3- -OH+HCO3- |
| A. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| D. | 医用酒精的浓度通常为95% |
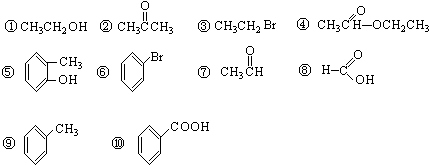
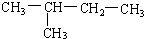 (8)
(8)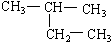 (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)