��Ŀ����
ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ����ʵ����⣮
��֪��CO��g��+H2O��g��?H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯���±���
�Իش��������⣺
��1��������Ӧ������Ӧ��
��2��ij�¶��£�������Ӧ�ﵽƽ���������������������¶ȣ�����Ӧ����
��3��830��ʱ���ں��ݷ�Ӧ���з���������Ӧ�����±��е����ʵ���Ͷ�뷴Ӧ��������������Ӧ������е���
��4��830��ʱ����2L���ܱ������м���4mol CO��g����6mol H2O��g���ﵽƽ��ʱ��CO�����������
��֪��CO��g��+H2O��g��?H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
��1��������Ӧ������Ӧ��
����
����
������ȡ������ȡ�����Ӧ����2��ij�¶��£�������Ӧ�ﵽƽ���������������������¶ȣ�����Ӧ����
����
����
�����������С�����䡱���������ڻ�������ѹǿ����
����
�����������С�����䡱������3��830��ʱ���ں��ݷ�Ӧ���з���������Ӧ�����±��е����ʵ���Ͷ�뷴Ӧ��������������Ӧ������е���
BC
BC
��ѡ����ĸ����| A | B | C | D | |
| n��CO2��/mol | 3 | 1 | 0 | 1 |
| n��H2��/mol | 2 | 1 | 0 | 1 |
| n��CO��/mol | 1 | 2 | 3 | 0.5 |
| n��H2O��/mol | 5 | 2 | 3 | 2 |
16%
16%
����Ӧ�ﵽƽ������¶Ⱥ�����������������м������4mol CO��g����6mol H2O��g���ﵽ��ƽ��ʱ��CO�������������
����
���������С�����䡱����������1������ƽ�ⳣ�����¶ȵı仯���ƽ���ƶ�ԭ�������жϷ�Ӧ�������仯�����ݱ������ݿ�֪���¶�����ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ���ѹǿ����
��3������830��ʱ��ƽ�ⳣ��k=1������Ũ�ȼ����ƽ�ⳣ���Ƚ��жϣ�
��4������ƽ������ʽ��ʽ���㷴Ӧ��һ����̼������ת���ʸ������õ���
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ���ѹǿ����
��3������830��ʱ��ƽ�ⳣ��k=1������Ũ�ȼ����ƽ�ⳣ���Ƚ��жϣ�
��4������ƽ������ʽ��ʽ���㷴Ӧ��һ����̼������ת���ʸ������õ���
����⣺��1�����ݱ������ݿ�֪���¶�����ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���������Ӧ���ȣ��ʴ�Ϊ�����ȣ�
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ�����Ӧǰ������������䣬����������ѹǿ֮�ȵ����¶�֮�ȣ�����ѹǿ���ʴ�Ϊ����������
��3������830��ʱ��ƽ�ⳣ��k=1���㣻
A��Q=
��1����Ӧ���淴Ӧ�����ƶ�����A����
B��Q=
��1����Ӧ������Ӧ�����ƶ�����B��ȷ��
C��ֻ�з�Ӧ���Ӧ������Ӧ�����ƶ�����C��ȷ��
D��Q=
=1���ﵽƽ��״̬��ƽ�ⲻ�ƶ�����D����
�ʴ�Ϊ��B��C��
��4��830��ʱ����2L���ܱ������м���4molCO��g����6molH2O��g���ﵽƽ��ʱ����һ����̼ת�����ʵ���Ϊx������ƽ������ʽ��ʽ�õ�
CO��g��+H2O��g��?H2��g��+CO2��g��
��ʼ����mol�� 4 6 0 0
�仯����mol�� x x x x
ƽ������mol�� 4-x 6-x x x
ƽ�ⳣ��K=
=1
x=2.4mol
CO���������=
��100%=
��100%=16%����Ӧ�ﵽƽ������¶Ⱥ�����������������м������4mol CO��g����6mol H2O��g���ﵽ����ƽ���ԭ����ƽ���ǵ�Чƽ�⣬CO�����������ȣ��ʴ�Ϊ��16%�����䣮
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ�����Ӧǰ������������䣬����������ѹǿ֮�ȵ����¶�֮�ȣ�����ѹǿ���ʴ�Ϊ����������
��3������830��ʱ��ƽ�ⳣ��k=1���㣻
A��Q=
| 2��3 |
| 5��1 |
B��Q=
| 1��1 |
| 0.5��2 |
C��ֻ�з�Ӧ���Ӧ������Ӧ�����ƶ�����C��ȷ��
D��Q=
| 1��1 |
| 2��0.5 |
�ʴ�Ϊ��B��C��
��4��830��ʱ����2L���ܱ������м���4molCO��g����6molH2O��g���ﵽƽ��ʱ����һ����̼ת�����ʵ���Ϊx������ƽ������ʽ��ʽ�õ�
CO��g��+H2O��g��?H2��g��+CO2��g��
��ʼ����mol�� 4 6 0 0
�仯����mol�� x x x x
ƽ������mol�� 4-x 6-x x x
ƽ�ⳣ��K=
| x2 |
| (4-x)(6-x) |
x=2.4mol
CO���������=
| 4-x |
| (4-x)+(6-x)+2x |
| 4-2.4 |
| 10 |
���������⿼�黯ѧƽ�ⳣ���ķ����жϣ�Ӱ�����ط�����ƽ�����Ӧ�ã���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�
�����Ŀ
 ��ҵ�ϳ����ô�����Ҵ��ϳ��л��ܼ�����������CH3COOH��l��+C2H5OH��l��
��ҵ�ϳ����ô�����Ҵ��ϳ��л��ܼ�����������CH3COOH��l��+C2H5OH��l��| ŨH2SO4 |
| �� |
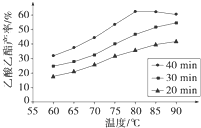
��֪CH3COOH��C2H5OH��CH3COOC2H5�ķе�����Ϊ118�桢78���77�森������������ͬʱ��ij�о�С������˶��ʵ�飬ʵ������ͼ��ʾ����1�����о�С���ʵ��Ŀ����
��2��60���·�Ӧ40min��70���·�Ӧ20min��ȣ�ǰ�ߵ�ƽ����Ӧ����
��3����ͼ��ʾ����Ӧʱ��Ϊ40min���¶ȳ���80��ʱ���������������½���ԭ�������
��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⣮
��֪��CO��g��+H2O��g��??H2��g��+CO2��g��ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
��1����800�淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ��������������Ӧ�����ƶ�����
| n��CO�� | n��H2O�� | n��H2�� | n��CO2�� | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C��s��+H2O��g��??CO��g��+H2��g����ƽ�ⳣ��ΪK1��
CO��g��+H2O��g��??H2��g��+CO2��g����ƽ�ⳣ��ΪK2��
��K��K1��K2֮��Ĺ�ϵ��
��3����V L�ܱ�������ͨ��10mol CO��10molˮ��������T��ﵽƽ�⣬Ȼ����ͨ����ʯ�ң������û������ȼ�գ���÷ų�������Ϊ2 842kJ����֪COȼ����Ϊ283kJ?mol-1��H2ȼ����Ϊ286kJ?mol-1������T��ƽ�ⳣ��K=
 H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����
H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯����� 2CO��g��ƽ�ⳣ��K��
2CO��g��ƽ�ⳣ��K�� CO��g��+H2��g�� ƽ�ⳣ��K1��
CO��g��+H2��g�� ƽ�ⳣ��K1�� H2��g��+CO2��g�� ƽ�ⳣ��K2��
H2��g��+CO2��g�� ƽ�ⳣ��K2��