题目内容
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表:
试回答下列问题:
(1)上述正向反应是:
(2)在800℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,
则K、K1、K2之间的关系是:
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K=
.
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
(1)上述正向反应是:
放热
放热
反应(选填:放热、吸热).(2)在800℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
BCE
BCE
(选填A、B、C、D、E).| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
 2CO(g)平衡常数K;
2CO(g)平衡常数K;C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;CO(g)+H2O(g)
 H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,则K、K1、K2之间的关系是:
K=
| K1 |
| K2 |
K=
.| K1 |
| K2 |
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:
75%
75%
.(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=
x
x
.(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K=
| 4 |
| 9 |
| 4 |
| 9 |
分析:(1)由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动;
(2)反应在同一容器内进行,体积相同,方程式中各物质的化学计量数都是1,所以在计算中均可用物质的量数值代替浓度数值,求出此时的浓度商Qc,平衡向正反应方向移动,浓度商小于平衡常数;
(3)根据化学平衡常数解答;
(4)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算;
(5)起始时水的物质的量为5xmol,转化的CO的物质的量为 5(1-x)ymol,利用三段式法求出平衡时各组分的物质的量,代入800℃平衡常数,据此解答;
(6)CO、H2的物质的量共为10mol,根据燃烧放出的热量求出CO、H2各自的物质的量,利用三段式法求出平衡时各组分的物质的量,代入平衡常数计算.
(2)反应在同一容器内进行,体积相同,方程式中各物质的化学计量数都是1,所以在计算中均可用物质的量数值代替浓度数值,求出此时的浓度商Qc,平衡向正反应方向移动,浓度商小于平衡常数;
(3)根据化学平衡常数解答;
(4)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算;
(5)起始时水的物质的量为5xmol,转化的CO的物质的量为 5(1-x)ymol,利用三段式法求出平衡时各组分的物质的量,代入800℃平衡常数,据此解答;
(6)CO、H2的物质的量共为10mol,根据燃烧放出的热量求出CO、H2各自的物质的量,利用三段式法求出平衡时各组分的物质的量,代入平衡常数计算.
解答:解:(1)由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动,故正反应为放热反应,故答案为:放热;
(2)反应在同一容器内进行,体积相同,方程式中各物质的化学计量数都是1,所以在计算中均可用物质的量数值代替浓度数值,800℃时反应平衡常数为1.
A、k=
=
=
,大于1,反应向逆反应进行,故A错误;
B、k=
=
=
,小于1,反应向正反应进行,故B正确;
C、开始只有CO、H2,反应向正反应进行,故C正确;
D、k=
=
=1,处于平衡状态,故D错误;
E、k=
=
=
,小于1,反应向正反应进行,故E正确;
故选:BCE;
(3)反应①C(s)+CO2(g) 2CO(g)平衡常数K=
2CO(g)平衡常数K=
;
反应②C(s)+H2O(g) CO(g)+H2(g)平衡常数K1=
CO(g)+H2(g)平衡常数K1=
;
反应③CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2=k=
H2(g)+CO2(g) 平衡常数K2=k=
;
反应②-反应③得反应①,所以K=
.
故答案为:K=
.
(4)令CO的浓度变化量为c,三段式法用c表示出平衡时各组分个浓度,
CO(g) H2O(g)
H2O(g) H2(g)
H2(g) CO2(g),
CO2(g),
起始(mol/L):0.02 0.020 0 0
转化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
代入500℃时反应平衡常数有k=
=
=9,解得c=0.015,
CO的最大所以转化率为
×100%=75%,
故答案为:75%;
(5)因800℃时反应平衡常数为1.
CO(g) H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g),
CO2(g),
起始:5(1-x) 5x 0 0
转化:5(1-x)y 5(1-x)y 5(1-x)y 5(1-x)y
平衡:5(1-x)(1-y) 5(x-y+xy) 5(1-x)y 5(1-x)y
所以平衡常数k=
=
=1,解得y=x,
故答案为:y=x;
(6)由方程式CO(g)+H2O(g)=H2(g)+CO2(g)可知,有1molCO反应则生成1molH2,开始通入10molCO,所以平衡时,CO、H2的物质的量共为10mol.则平均燃烧热为
=284.2kJ/mol,
利用十字交叉法计算CO、H2的物质的量之比,

即CO、H2的物质的量之比为1.8kJ/mol:1.2kJ/mol=3:2,
所以n(CO)=10mol×
=6mol,n(H2)=10mol-6mol=4mol.
利用三段式法求出平衡时各组分的物质的量,
CO(g)+H2O(g)=H2(g)+CO2(g),
起始:10mol 10mol 0 0
转化:4mol 4 mol 4mol 4mol
平衡:6mol 6mol 4mol 4mol
所以常数平衡常数为Kk=
=
=
.
故答案为:
.
(2)反应在同一容器内进行,体积相同,方程式中各物质的化学计量数都是1,所以在计算中均可用物质的量数值代替浓度数值,800℃时反应平衡常数为1.
A、k=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 2×3 |
| 1×5 |
| 6 |
| 5 |
B、k=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 1×1 |
| 2×2 |
| 1 |
| 4 |
C、开始只有CO、H2,反应向正反应进行,故C正确;
D、k=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 1×1 |
| 0.5×2 |
E、k=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 2×1 |
| 3×1 |
| 2 |
| 3 |
故选:BCE;
(3)反应①C(s)+CO2(g)
 2CO(g)平衡常数K=
2CO(g)平衡常数K=| [c(CO)]2 |
| c(CO2) |
反应②C(s)+H2O(g)
 CO(g)+H2(g)平衡常数K1=
CO(g)+H2(g)平衡常数K1=| c(H2)c(CO) |
| c(H2O) |
反应③CO(g)+H2O(g)
 H2(g)+CO2(g) 平衡常数K2=k=
H2(g)+CO2(g) 平衡常数K2=k=| c(H2)c(CO2) |
| c(CO)c(H2O) |
反应②-反应③得反应①,所以K=
| K1 |
| K2 |
故答案为:K=
| K1 |
| K2 |
(4)令CO的浓度变化量为c,三段式法用c表示出平衡时各组分个浓度,
CO(g)
 H2O(g)
H2O(g) H2(g)
H2(g) CO2(g),
CO2(g),起始(mol/L):0.02 0.020 0 0
转化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
代入500℃时反应平衡常数有k=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c×c |
| (0.02-c)×(0.02-c) |
CO的最大所以转化率为
| 0.015mol/L |
| 0.02mol/L |
故答案为:75%;
(5)因800℃时反应平衡常数为1.
CO(g)
 H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g),
CO2(g),起始:5(1-x) 5x 0 0
转化:5(1-x)y 5(1-x)y 5(1-x)y 5(1-x)y
平衡:5(1-x)(1-y) 5(x-y+xy) 5(1-x)y 5(1-x)y
所以平衡常数k=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 5(1-x)y×5(1-x)y |
| 5(1-x)(1-y)×5(x-y+xy) |
故答案为:y=x;
(6)由方程式CO(g)+H2O(g)=H2(g)+CO2(g)可知,有1molCO反应则生成1molH2,开始通入10molCO,所以平衡时,CO、H2的物质的量共为10mol.则平均燃烧热为
| 2842kJ |
| 10mol |
利用十字交叉法计算CO、H2的物质的量之比,

即CO、H2的物质的量之比为1.8kJ/mol:1.2kJ/mol=3:2,
所以n(CO)=10mol×
| 3 |
| 5 |
利用三段式法求出平衡时各组分的物质的量,
CO(g)+H2O(g)=H2(g)+CO2(g),
起始:10mol 10mol 0 0
转化:4mol 4 mol 4mol 4mol
平衡:6mol 6mol 4mol 4mol
所以常数平衡常数为Kk=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 4×4 |
| 6×6 |
| 4 |
| 9 |
故答案为:
| 4 |
| 9 |
点评:本题主要考查平衡常数及其计算,难度较大,注意(1)平衡常数书写,(2)平衡常数只受温度影响,同一反应温度不变,平衡常数不变.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
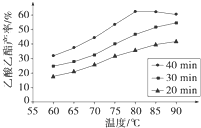 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃.在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示.(1)该研究小组的实验目的是
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
Ⅱ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)??H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C(s)+H2O(g)??CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2O(g)??H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是
(3)在V L密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2 842kJ(已知CO燃烧热为283kJ?mol-1,H2燃烧热为286kJ?mol-1),则T℃平衡常数K=