题目内容
12.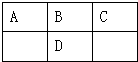 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )| A. | H2CO3 | B. | H2SO4 | C. | HNO3 | D. | H3PO |
分析 由短周期元素A、B、C、D在元素周期表中的相对位置,可知A、B、C处于第二周期,D处于第三周期,令B的质子数为x,则A、C、D的质子数分别为x-1、x+1、x+8,则x-1+x+x+1+x+8=32,解得x=6,故B为碳元素,可推知A为硼元素、C为N元素、D为Si元素,非金属性越强最高价含氧酸的酸性越强.
解答 解:由短周期元素A、B、C、D在元素周期表中的相对位置,可知A、B、C处于第二周期,D处于第三周期,令B的质子数为x,则A、C、D的质子数分别为x-1、x+1、x+8,则x-1+x+x+1+x+8=32,解得x=6,故B为碳元素,可推知A为硼元素、C为N元素、D为Si元素,它们的最高价氧化物对应水化物酸性最强的是HNO3,故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解掌握同主族元素原子序数之间的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,则下列有关说法中不正确的是( )
| A. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| B. | NH5中既有共价键又有离子键,是离子化合物 | |
| C. | NH5的熔沸点高于NH3 | |
| D. | NH5固体投入少量水中,可产生两种气体 |
3.将X g聚苯乙烯树脂溶于Y L苯中,然后通入Z mol乙炔气体,所得混合液中C、H两元素的质量比为( )
| A. | 6:1 | B. | 12:1 | C. | 1:1 | D. | 1:2 |
20.下列描述中正确的是( )
| A. | 氮原子的价电子排布图: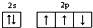 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第VA族,是p区元素 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 第一电离能和电负性:1s22s22p4>1s22s22p3 |
7.向100mL 18mol/L H2SO4溶液中加入足量的铜片并加热.充分反应后,则的参加反应H2SO4的物质的量( )
| A. | 小于1.8mol | B. | 等于0.9mol | C. | 等于1.8mol | D. | 大于1.8mol |
17.某烃和Cl2充分加成的产物其结构简式为 ,则原有机物一定是( )
,则原有机物一定是( )
 ,则原有机物一定是( )
,则原有机物一定是( )| A. | 2-丁炔 | B. | 2-甲基-1,4-二氯-2-丁烯 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二烯 |
4.下列混合物可用加热的方法分离的是( )
| A. | 碘和氯化铵 | B. | 硫酸钾和氯酸钾 | ||
| C. | 氯化铵和硫酸钡 | D. | 碳酸氢钠和碳酸氢铵 |
1.下列属于纯净物的是( )
| A. | 汽油 | B. | 煤 | C. | 乙烯 | D. | 石油裂解气 |