题目内容
在含有2 molH2SO4的浓硫酸中加入足量锌粉,使其充分反应,则下列推断中错误的是
①放出的气体中除SO2外还有H2
②只放出SO2气体,其物质的量为1 mol
③反应结束时转移电子的物质总共为4 mol
- A.①
- B.②
- C.②③
- D.①②
C
解析:
浓硫酸具有强氧化性,与锌反应放出二氧化硫气体,随着硫酸的消耗,浓硫酸变成稀硫酸,与锌反应生成氢气.在生成二氧化硫反应中,每消耗1 mol硫酸转移1 mol电子,在生成氢气的反应中,每消耗1 mol硫酸转移2 mol电子,因此反应结束时转移电子的物质的量小于4 mol.
解析:
浓硫酸具有强氧化性,与锌反应放出二氧化硫气体,随着硫酸的消耗,浓硫酸变成稀硫酸,与锌反应生成氢气.在生成二氧化硫反应中,每消耗1 mol硫酸转移1 mol电子,在生成氢气的反应中,每消耗1 mol硫酸转移2 mol电子,因此反应结束时转移电子的物质的量小于4 mol.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
 (2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.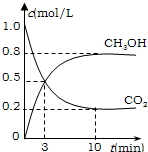 为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
 互为同系物.
互为同系物.  ,并使原子利用率达100%,已知:
,并使原子利用率达100%,已知:

