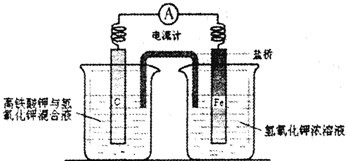
题目内容
已知可充电高铁电池的反应为3Zn +2K2FeO4 +8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 [ ]
A.该电池的负极材料是Zn(OH)2
B.放电时正极反应:FeO42- +4H2O+3e-==Fe(OH)3 +5OH-
C.该电池在放电过程中碱性增强
D.该电池使用的介质为氢氧化钾溶液
B.放电时正极反应:FeO42- +4H2O+3e-==Fe(OH)3 +5OH-
C.该电池在放电过程中碱性增强
D.该电池使用的介质为氢氧化钾溶液
A

练习册系列答案
相关题目