题目内容
【题目】298K时,向20mL浓度均为0.1 mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知CH3COOH的Ka=1.8×10-5,NH3·H2O的Kb =1.8×10-5。下列说法正确的是
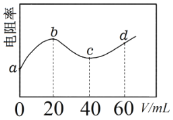
A.b→c过程发生的反应:MOH+CH3COOH=CH3COOM+H2O
B.c点溶液中:c(CH3COOH)+c(CH3COO–)=2c(NH4+)
C.d 点溶液中:c(CH3COO–)c(CH3COOH)>c(M+)>c(H+)>c(OH–)
D.a→c过程中水的电离程度一直在增大
【答案】D
【解析】
溶液中离子浓度越小,溶液的导电率越小,电阻率越大,向混合溶液中加入等物质的量浓度的CH3COOH溶液时,发生反应先后顺序是:MOH+CH3COOH=CH3COOM+H2O,NH3·H2O+CH3COOH=CH3COONH4+H2O,a-b溶液中电阻率增大,b点最大,因为溶液体积增大导致b点离子浓度减小,b点溶液中溶质为CH3COOM和NH3·H2O。继续加入醋酸溶液,NH3·H2O是弱电解质,生成CH3COONH4是强电解质,导致溶液中离子浓度增大,电阻率减小,c点时醋酸和NH3·H2O恰好完全反应生成醋酸,c点溶液中溶质为CH3COOM和CH3COONH4,且二者的物质的量相等,溶液中离子浓度增大,电阻率减小;随着CH3COOH溶液继续加入,溶液体积增大,离子浓度减小,溶液电阻率逐渐增大。据此分析。
A.由图可知,向混合溶液中加入等物质量浓度的CH3COOH溶液时,电阻率先增大后减小,说明发生了两步反应,发生反应先后顺序为:MOH+CH3COOH=CH3COOM+H2O,NH3·H2O+CH3COOH=CH3COONH4+H2O,所以MOH是强碱,先和酸反应,A项错误;
B.c点时,加入醋酸40mL,此时溶液中的溶质为CH3COOM和CH3COONH4,且二者的物质的量浓度相等,根据物料守恒,则有c(CH3COOH)+c(CH3COO–)=2[c(NH4+)+c(NH3·H2O)],B项错误;
C.d点时加入醋酸60mL,溶液中溶质为CH3COOM、CH3COONH4和CH3COOH,且三者的物质的量浓度相等,CH3COONH4是中性盐,溶液相当于CH3COOM和CH3COOH等物质的量混合,根据![]() ,可知CH3COOH的电离程度大于CH3COO–的水解程度,所以溶液显酸性,溶液中离子浓度大小顺序为:c(CH3COO–)>c(M+)>c(CH3COOH)>c(H+)>c(OH–),C项错误;
,可知CH3COOH的电离程度大于CH3COO–的水解程度,所以溶液显酸性,溶液中离子浓度大小顺序为:c(CH3COO–)>c(M+)>c(CH3COOH)>c(H+)>c(OH–),C项错误;
D.a→c过程中,溶液碱性逐渐减弱,水电离程度增大,D项正确;
答案选D。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案