题目内容
I.某化学兴趣小组利用蔗糖、氯化铵、熟石灰和硫酸四种药品,按图甲所示方案从含Fe3+和Al3+的AgNO3废液中提取银.
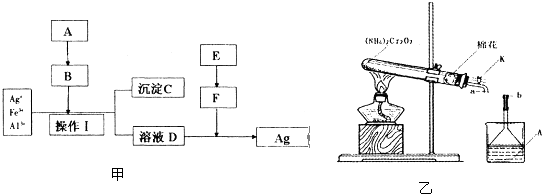
(1)气体B的结构式为 .
(2)操作I的名称为 ,该操作要用到的主要玻璃仪器有烧杯、漏斗和
(3)溶液D与F反应的离子方程式为
II.重铬酸铵[(NH4)2Cr2O7]是一种橘黄色的晶体,常用于石油精炼、制革、印染、烟火、陶瓷等行业,是一种重要的化工原料.
(1)已知在酸性条件下,重铬酸盐有强氧化性.向冷的酸性重铬酸铵溶液中通入H2S,可得到Cr3+和S,该反应的离子方程式为
(2)在150℃时,重铬酸铵迅速呈膨胀式分解,发生的主要反应为:(NH4)2Cr2O7═CrO3(绿色固体)+4H2O+N2↑但同时要发生副反应.某同学设计了如图乙所示装置,探究副反应的生成物.
①加热前,该同学先打开活塞K向试管中通一会儿N2,其目的是
②装置A中所盛溶液为新制的硫酸亚铁溶液,连接a、b,关闭活塞K,加热使反应发生.一段时间后,观察到试管中固体变为绿色,装置A中出现红褐色沉淀,且整套装置内的气体始终为无色.据此判断:副反应的化学方程式为 .

(1)气体B的结构式为
(2)操作I的名称为
(3)溶液D与F反应的离子方程式为
II.重铬酸铵[(NH4)2Cr2O7]是一种橘黄色的晶体,常用于石油精炼、制革、印染、烟火、陶瓷等行业,是一种重要的化工原料.
(1)已知在酸性条件下,重铬酸盐有强氧化性.向冷的酸性重铬酸铵溶液中通入H2S,可得到Cr3+和S,该反应的离子方程式为
(2)在150℃时,重铬酸铵迅速呈膨胀式分解,发生的主要反应为:(NH4)2Cr2O7═CrO3(绿色固体)+4H2O+N2↑但同时要发生副反应.某同学设计了如图乙所示装置,探究副反应的生成物.
①加热前,该同学先打开活塞K向试管中通一会儿N2,其目的是
②装置A中所盛溶液为新制的硫酸亚铁溶液,连接a、b,关闭活塞K,加热使反应发生.一段时间后,观察到试管中固体变为绿色,装置A中出现红褐色沉淀,且整套装置内的气体始终为无色.据此判断:副反应的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:Ⅰ、流程分析可知,从含Fe3+和Al3+的AgNO3废液中提取银,利用氯化铵和熟石灰加热反应生成氨气,通入废液中沉淀铁离子、铝离子,银离子溶液过滤氨水生成银氨溶液,蔗糖水解生成F为葡萄糖,葡萄糖和银氨溶液加热反应提取得到银单质;
(1)气体B为氨气是共价化合物;
(2)操作Ⅰ是分离固体和溶液,利用过滤进行分离混合物,依据过滤装置选择需要的玻璃仪器;
(3)溶液D与F反应溶液D与F反应是葡萄糖和银氨溶液加热发生反应生成葡萄糖酸铵,银,氨气和水,结合原原子守恒和反应原理书写离子方程式;
Ⅱ、(1)酸性重铬酸铵溶液中,重铬酸根离子具有强氧化性,可以将还原性的H2S氧化,根据反应物和产物书写化学方程式即可;
(2)①固体物质加热产生的氧化铬可以将导管堵塞,根据实验目的来回答.
(1)气体B为氨气是共价化合物;
(2)操作Ⅰ是分离固体和溶液,利用过滤进行分离混合物,依据过滤装置选择需要的玻璃仪器;
(3)溶液D与F反应溶液D与F反应是葡萄糖和银氨溶液加热发生反应生成葡萄糖酸铵,银,氨气和水,结合原原子守恒和反应原理书写离子方程式;
Ⅱ、(1)酸性重铬酸铵溶液中,重铬酸根离子具有强氧化性,可以将还原性的H2S氧化,根据反应物和产物书写化学方程式即可;
(2)①固体物质加热产生的氧化铬可以将导管堵塞,根据实验目的来回答.
解答:
解:Ⅰ、(1)气体B为氨气是共价化合物,结构式为: ;
;
故答案为: ;
;
(2)操作Ⅰ是分离固体和溶液,利用过滤进行分离混合物,依据过滤装置选择需要的玻璃仪器主要是烧杯、漏斗和玻璃棒;
故答案为:过滤,玻璃棒;
(3)溶液D与F反应溶液D与F反应是葡萄糖和银氨溶液加热发生反应生成葡萄糖酸铵,银,氨气和水,反应的离子方程式为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O;
故答案为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O;
Ⅱ、(1)酸性重铬酸铵溶液中,重铬酸根离子具有强氧化性,可以将还原性的H2S氧化,发生反应的化学方程式为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O,
故答案为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O;
(2)①固体物质加热产生的氧化铬可以将导管堵塞,所以装置中棉花的作用是防止粉尘堵塞导管,为了防止副反应的发生防止氧气对实验的干扰,在实验之前要先赶走试管及导管内空气(氧气),
故答案为:赶走试管及导管内空气(氧气);
②装置A中所盛溶液为新制的硫酸亚铁溶液,连接a、b,关闭活塞K,加热使反应发生.一段时间后,观察到试管中固体变为绿色,装置A中出现红褐色沉淀,且整套装置内的气体始终为无色,存在的副反应为铬酸铵分解生成氧化铬、氧气、氨气和水,反应的化学方程式为:2(NH4)2Cr2O7=3O2↑+2Cr2O3+2H2O+4NH3↑;
故答案为:2(NH4)2Cr2O7=3O2↑+2Cr2O3+2H2O+4NH3↑;
 ;
;故答案为:
 ;
;(2)操作Ⅰ是分离固体和溶液,利用过滤进行分离混合物,依据过滤装置选择需要的玻璃仪器主要是烧杯、漏斗和玻璃棒;
故答案为:过滤,玻璃棒;
(3)溶液D与F反应溶液D与F反应是葡萄糖和银氨溶液加热发生反应生成葡萄糖酸铵,银,氨气和水,反应的离子方程式为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O;
故答案为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O;
Ⅱ、(1)酸性重铬酸铵溶液中,重铬酸根离子具有强氧化性,可以将还原性的H2S氧化,发生反应的化学方程式为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O,
故答案为:Cr2O72-+3H2S+8H+═2Cr3++3S↓+7H2O;
(2)①固体物质加热产生的氧化铬可以将导管堵塞,所以装置中棉花的作用是防止粉尘堵塞导管,为了防止副反应的发生防止氧气对实验的干扰,在实验之前要先赶走试管及导管内空气(氧气),
故答案为:赶走试管及导管内空气(氧气);
②装置A中所盛溶液为新制的硫酸亚铁溶液,连接a、b,关闭活塞K,加热使反应发生.一段时间后,观察到试管中固体变为绿色,装置A中出现红褐色沉淀,且整套装置内的气体始终为无色,存在的副反应为铬酸铵分解生成氧化铬、氧气、氨气和水,反应的化学方程式为:2(NH4)2Cr2O7=3O2↑+2Cr2O3+2H2O+4NH3↑;
故答案为:2(NH4)2Cr2O7=3O2↑+2Cr2O3+2H2O+4NH3↑;
点评:本题考查了物质分离实验方案的分析判断,物质性质和试剂选择,实验基本操作是解题关键,题目难度中等.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
下列叙述正确的是( )
| A、纯碱、烧碱均属碱 |
| B、SO3、SO2均属酸性氧化物 |
| C、凡能电离出H+的化合物均属酸 |
| D、盐类物质一定含有金属离子 |
下列各组试剂在溶液中的反应,当两种试剂的量发生变化时,不能用同一离子反应方程式表示的是( )
| A、氯化镁、氢氧化钠 |
| B、硫酸钠、氢氧化钡 |
| C、氯化铝、氨水 |
| D、溴化亚铁、氯水 |
在反应:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4 中15mol CuSO4 氧化的P原子的物质的量为( )
| A、3mol |
| B、11 mol |
| C、6 mol |
| D、5 mol |