题目内容
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图,有关说法不正确的是( )
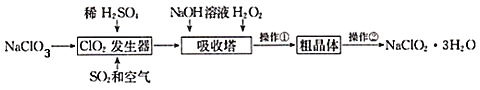
A.NaOH的电子式为![]()
B.加入的H2O2起氧化作用
C.ClO2发生器中发生反应的离子方程式为2ClO3﹣+SO2 ═2ClO2+SO42﹣
D.操作②实验方法是重结晶
【答案】B
【解析】
ClO2发生器中发生反应生成ClO2和NaHSO4,反应后通入空气,可将ClO2赶入吸收器,加入NaOH、过氧化氢,可生成NaClO2,过氧化氢被氧化生成氧气,经冷却结晶、重结晶、干燥得到NaClO2.3H2O,以此解答该题。
A.书写电子式时原子团用中括号括起来,NaOH的电子式![]() ,故A正确;
,故A正确;
B.在吸收塔中二氧化氯生成亚氯酸钠,氯元素化合价由+4变为+3,化合价降低做氧化剂,有氧化必有还原,H2O2做还原剂起还原作用,故B不正确;
C.ClO2发生器中发生反应的离子方程式为2ClO3﹣+SO2 ═2ClO2+SO42﹣,故C正确;
D.将粗晶体进行精制,可以采用重结晶,故D正确;
故选:B。

 名校课堂系列答案
名校课堂系列答案【题目】研究大气污染物的处理,对缓解和治理环境污染、保护我们赖以生存的地球,具有十分重要的意义。
(1)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5/kJmol
N2(g)+O2(g)═2NO(g)△H=+180kJ/mol
则C(s)+2NO(g)═CO2(g)+N2(g) 的△H=_____kJ/mol。
(2)在一定温度下,向2L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)4CO2(g)+N2(g),测得相关数据如表所示:
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
①在0~5 min内,用CO2的浓度变化表示的反应速率为_____。
②此温度下的化学平衡常数K的表达式为_____。
(3)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)![]() CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
①下列描述能说明上述反应已达平衡的是_____(填标号)。
A.活性炭的质量不再变化
B.容器中气体的密度保持不变
C.2v(NO)正 =v(N2)逆
D. 保持不变
保持不变
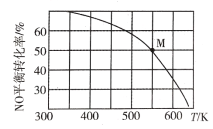
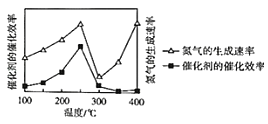
②压强为p时,催化剂的催化效率、氮气的生成速率与温度的关系如图所示。当氮气的生成速率主要取决于温度时,对应的温度范围是_____。
(4)肼(N2H4)是无色液体,具有强还原性。
①肼的水溶液显弱碱性,其电离过程与NH3H2O类似,则第一步电离方程式为_____。
②新型N2H4燃料电池产物对环境没有污染,该电池以固体氧化物为电解质(能传导O2﹣)。写出负极的电极反应式_____。