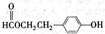题目内容
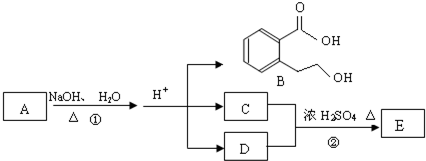
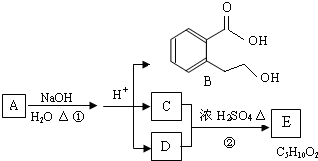
(10分)A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
(1)若A是短周期中原子半径最大的元素构成的单质,E 既可溶于盐酸又可溶于NaOH
溶液,E 溶于NaOH 溶液的离子方程式为 ;工业上冶炼A 的化学反应方程式为 。
(2)若A为红色金属,B为某酸的浓溶液,C 为可形成酸雨的无色气体。则A 与B反应的化学方程式为 。
(3)若B为某酸式盐的溶液,C 是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式为 ;0.1molC 完全燃烧生成液态水时放热130kJ·mol-1,则表达C 燃烧热的热化学方程式是 。
(1)Al(OH)3+OH-==AlO-2+2H2O(2分)
2NaCl(熔融)2Na+Cl2↑(2分)
(2)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(2分)
(3)CaC2+2H2O→C2H2↑+Ca(OH)2(2分)
C2H2(g)+O2(g)→2CO2(g)+H2O(l) △H=-1300kJ·mol-1(2分)
解析:

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目