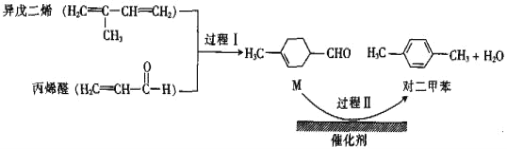
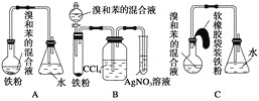
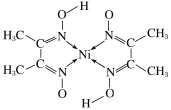
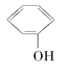
题目内容
【题目】下列说法不正确的是( )
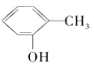
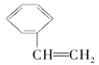
A.N2O与CO2、CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.H2CO3与H3PO4的C、P杂化相同
D.由第ⅠA族和第ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子化合物
【答案】C
【解析】
A.N2O与CO2的原子数相同,价电子总数相同,CCl3F与CCl2F2的原子数相同,价电子总数相同,它们互为等电子体,故A不符合题意;
B.CCl2F2无同分异构体,说明它是立体结构而不是平面结构,则碳原子采用sp3方式杂化,故B不符合题意;
C.H2CO3的C的价层电子对数为![]() ,C采取sp2杂化,H3PO4的P的价层电子对数为
,C采取sp2杂化,H3PO4的P的价层电子对数为![]() ,P采取sp3杂化,C项符合题意;
,P采取sp3杂化,C项符合题意;
D.由第ⅠA族和第ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物为Na2O2,Na2O2为含有(非极性)共价键的离子化合物,故D不符合题意;
故答案为:C。

【题目】已知:-CHO+(C6H5)3P=CH-R -CH=CH-R + (C6H5)3P=O,R代表原子或原子团,W是一种有机合成中间体,结构简式为:HOOC-CH=CH-CH=CH-COOH,其合成方法如下:
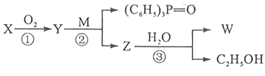
其中,![]() 分别代表一种有机物,合成过程中其他产物和反应条件已略去。
分别代表一种有机物,合成过程中其他产物和反应条件已略去。
X与W在一定条件下反应可以生成酯N,N的相对分子质量为168。
请回答下列问题:
(1)W能发生反应的类型有__________。(填写字母编号)
A.取代反应 | B.水解反应 | C.氧化反应 | D.加成反应 |
(2)写出X与 W在一定条件下反应生成N的化学方程式:___________________。
(3)写出含有3个碳原子且不含甲基的X的同系物的结构简式_________________
(4)写出第②步反应的化学方程式:____________________________________。
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
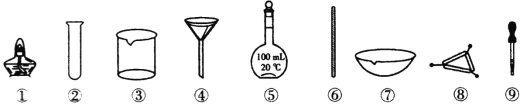
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。