题目内容
已知FeS2与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:3,则该反应的还原产物是( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、NH4NO3 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:根据题给信息知,FeS2和HNO3的反应中生成硝酸铁、硫酸和氮氧化物,根据氧化还原反应中得失电子数相等确定氮氧化物的化学式.
解答:
解:根据题给信息知,FeS和HNO3的反应中生成硝酸铁、硫酸和氮氧化物,若参与氧化还原反应的FeS和HNO3的物质的量之比是1:3,
该反应中失去的电子数=[(3-2)+(6-(-2))]=9,设氮氧化物中N元素的化合价是X,则得到的电子总数=(5-x)×3=9,所以x=2,即氮氧化物的化学式为NO,
故选B.
该反应中失去的电子数=[(3-2)+(6-(-2))]=9,设氮氧化物中N元素的化合价是X,则得到的电子总数=(5-x)×3=9,所以x=2,即氮氧化物的化学式为NO,
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确元素化合价是解本题的关键,注意从得失电子数目相等角度解答该题,难度不大.

练习册系列答案
相关题目
分子式为C6H12O2的酯经水解后,生成醇A和羧酸B,若A经氧化后生成B,则这种酯的结构可能有( )
| A、1种 | B、2种 |
| C、3种 | D、4种 E、5种 |
下列叙述正确的是( )
| A、测定相同温度下盐酸和醋酸溶液的pH,可证明盐酸是强酸、醋酸是弱酸 |
| B、改变温度能改变任何可逆反应的平衡状态 |
| C、离子反应的结果是自由移动的离子浓度减小 |
| D、Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,可通过丁达尔效应区分二者 |
异丁烷的二氯代物共有(不考虑立体异构)( )
| A、5种 | B、4种 | C、3种 | D、2种 |
铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低.已知反应:
BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )
BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )
| A、Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO |
| B、BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeCl2 |
| C、Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D、BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
2012年,将在京津冀、长三角、珠三角等重点区域以及直辖市和省会城市开展PM2.5(PM2.5是指大气中直径接近于2.5×10 -6m的颗粒物)和臭氧监测,下列有关说法正确的是( )
| A、PM2.5在空气中形成了气溶胶 |
| B、同温同压条件下,等质量的氧气和臭氧体积比为2:3 |
| C、16g臭氧中含有NA个原子 |
| D、1.00 mol臭氧中含有电子总数为18NA |
设NA表示阿伏加德罗常数的值.下列有关说法正确的是( )
| A、在标准状况下,2.24L氮气含有共用电子对数的0.5NA |
| B、22.4g铁粉完全溶于一定浓度的硝酸中,转移的电子数可能为0.6NA |
| C、4.6g甲醇和二甲醚(CH3-O-CH3)的混合物中所含分子数等于0.1NA |
| D、含Al3+数目为0.1NA的硝酸铝溶液中,NO3-个数大于0.3NA |
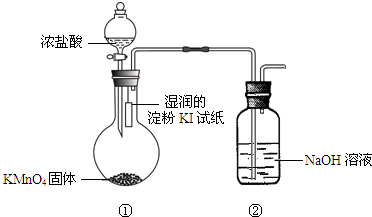 欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).
欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气). 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1