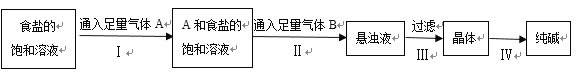
题目内容
【题目】某元素原子的电子排布式为![]() ,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第______周期,该周期的元素种数是______;
(2)该元素处于元素周期表的第______族,该族的非金属元素种数是______。
(3)试推测该元素处于元素周期表的______区,该区包含族的种类是______。
【答案】四 18 ⅢA 1 p ⅢA~ⅦA族、0族
【解析】
(1)电子层数=周期数,由核外电子排布可知,该元素处于第四周期,含有18种元素;
(2)根据外围电子排布可知,为主族元素,主族族序数=最外层电子数,非金属性元素的最外层电子数大于电子层数,据此判断;
(3)根据价层电子排布为4s24p1,可以确定该元素在p区,ⅡA~ⅦA族、零族。
(1)根据元素原子有4个电子层容纳电子,则该元素处于第四周期,该周期元素原子的电子排布式为[Ar]3d1-104s1-24p1-6,故共有18种元素;
(2)由外围电子排布为4s24p1,可知该元素处于p区,为主族元素,最外层电子数为3,处于ⅢA族,本族元素只有一种非金属元素--硼;
(3)由外围电子排布为4s24p1,可知该元素处于p区,由该区元素的价层电子的电子排布为ns24p1-6,可以确定所包含元素族的种数为ⅢA~ⅦA族、零族。

 口算能手系列答案
口算能手系列答案【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25 |
|
|
|
下列选项错误的是( )
A.CN + H2O + CO2 → HCN +HCO3﹣
B.2HCOOH + CO32﹣ → 2HCOO + H2O + CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者