题目内容
8.下列推论正确的是( )| A. | HC1为强电解质,可推测HF也为强电解质 | |
| B. | NH4+为正四面体结构,可推测PH4+也为正四面体结构 | |
| C. | C02晶体是分子晶体,可推测Si02晶体也是分子晶体 | |
| D. | C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子 |
分析 A. HF是弱酸,是弱电解质;
B.根据微粒增大中心原子的价层电子对数判断;
C.Si02晶体是原子晶体;
D.乙烷中两个甲基对称,是非极性分子,而C3H8是锯齿形结构,是极性分子.
解答 解:A.HC1为强电解质,HF是弱酸,是弱电解质,故A错误;
B.NH4+的中心原子N原子含有4个成键电子对,没有孤对电子,为正四面体结构,PH4+的中心原子P原子含有4个成键电子对,没有孤对电子,为正四面体结构,故B正确;
C.C02晶体是分子晶体,但Si02晶体是原子晶体,故C错误;
D.乙烷中两个甲基对称,是非极性分子,而C3H8是锯齿形结构,不对称,所以是极性分子,故D错误;
故选B.
点评 本题考查较为综合,涉及电解质的分类、物质与化学键的关系、晶体类型、分子极性的判断等知识点,根据物质中存在的化学键及发生的反应、分子极性的判断方法等知识点来分析解答,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
18.下列有关物质性质的应用正确的是( )
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 生石灰能与水反应,可用来干燥氯气 | |
| D. | 氯化铝是由金属元素和非金属元素组成的化合物,属于离子化合物 |
19.下列氯化物中,不能用单质跟氯气直接反应制得的是( )
| A. | NaC1 | B. | HCI | C. | FeCl2 | D. | CuCl2 |
16.取Xg镁和铝的混合物,向其中加入适量的稀盐酸,恰好完全反应生成标准状况下的气体BL向反应后的溶液中加入VmLCmol/L氢氧化钠溶液,使金属离子刚好沉淀完全,得到的沉淀质量为Yg.再将得到的沉淀灼烧至质量不再改变为止,得到固体Pg.则下列关系不正确的是( )
| A. | $\frac{5}{3}$X<P<$\frac{17}{9}$X | B. | P=X+$\frac{V•C}{12.5}$ | C. | Y=X+V•C | D. | C=$\frac{1000B}{11.2V}$ |
3.五种短周期元素在元素周期表中的相对位置如表所示,其中E的非金属性在同周期元素中最强,下列说法正确的是( )
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
13.在恒温恒容密闭容器中充入2mol Z发生如下反应:2Z(g)?X2(g)+Y2(g),下列说法不正确的是( )
| A. | 当2v(X2)正=v(Z)逆时,反应达到平衡 | |
| B. | 当容器压强不随时间变化时,反应达到平衡 | |
| C. | 当反应达到平衡时,X2的物质的量小于1mol | |
| D. | 当反应达到平衡时,容器里X2、Y2、Z在容器中共存 |
20.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 黑火药的使用 | D. | 打磨磁石制指南针 |
17.下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
| 选项 | X | Y | Z | 箭头上为反应条件或试剂 | 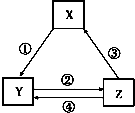 |
| A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
| B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2、再通过量NH3 | |
| C | SiO2 | Na2SiO3 | H2SiO3 | ③加热 | |
| D | NaAlO2 | Al(OH)3 | Al2O3 | ④加H2O |
| A. | A | B. | B | C. | C | D. | D |
18.将乙醇1mol(其中的羟基氧用 18O 标记)在浓硫酸存在并加热下与足量乙酸充分反应.下列叙述不正确的是( )
| A. | 不可能生成90g 乙酸乙酯 | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成61.6g 乙酸乙酯 | D. | 生成的水分子中一定含有18O |