题目内容
在下列溶液中,能大量共存的离子组是( )
| A、Na+、SO42-、HCO3- |
| B、CO32-、K+、Ca2+ |
| C、Fe3+、Cl-、OH- |
| D、Ag+、K+、Cl- |
考点:离子共存问题
专题:离子反应专题
分析:A.Na+、SO42-、HCO3-离子之间不满足离子反应发生条件;
B.碳酸根离子与钙离子反应生成碳酸钙沉淀;
C.铁离子与氢氧根离子反应生成氢氧化铁沉淀;
D.银离子与氯离子反应生成氯化银沉淀.
B.碳酸根离子与钙离子反应生成碳酸钙沉淀;
C.铁离子与氢氧根离子反应生成氢氧化铁沉淀;
D.银离子与氯离子反应生成氯化银沉淀.
解答:
解:A.Na+、SO42-、HCO3-离子之间不发生反应,在溶液中能够大量共存,故A正确;
B.CO32-、Ca2+离子之间反应生成难溶物碳酸钙,在溶液中不能大量共存,故B错误;
C.Fe3+、OH-离子之间反应生成难溶物氢氧化铁,在溶液中不能大量共存,故C错误;
D.Ag+、Cl-之间发生反应生成AgCl沉淀,在溶液中不能大量共存,故D错误;
故选A.
B.CO32-、Ca2+离子之间反应生成难溶物碳酸钙,在溶液中不能大量共存,故B错误;
C.Fe3+、OH-离子之间反应生成难溶物氢氧化铁,在溶液中不能大量共存,故C错误;
D.Ag+、Cl-之间发生反应生成AgCl沉淀,在溶液中不能大量共存,故D错误;
故选A.
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
单质碘的熔沸点较低,其原因是( )
| A、碘的非金属性较弱 |
| B、碘分子中键能较小 |
| C、碘晶体中碘分子间以范德华力结合 |
| D、I-I共价键的键长较长 |
X、Y、Z、M是原子序数依次递增的短周期元素,Z原子核外电子总数等于X和Y 核外电子数总数之和,X、Z、M分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A、X分别与Y和Z形成的化合物原子个数比不可能相同 |
| B、X与Y形成的化合物的沸点比X与Z形成的化合物的沸点低 |
| C、1mol CaY2与SO2发生氧化还原反应时,转移2mol电子 |
| D、CaX2、CaY2、CaZ2和CaM2等4种化合物中,阳离子与阴离子个数比均为1:2 |
下列晶体直接由原子构成的有( )
| A、硫磺 | B、石英晶体 |
| C、晶体硅 | D、金属铝 |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、常温下pH相同的下列溶液:①NaHCO3 ②Na2CO3 ③CH3COONa,其溶液的浓度由大到小的顺序是:③>①>② |
| B、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
| C、pH=10的NaOH溶液与pH=4的CH3COOH溶液等体积混合:C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| D、0.1mol/L的氨水溶液与0.05mol/LH2SO4溶液等体积混合后所得溶液中:C(NH4+)+C(NH3?H2O)+C(NH3)═C(SO42-) |
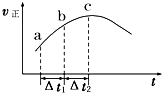 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )| A、反应在 c 点达到平衡状态 |
| B、反应物浓度:a 点小于 b 点 |
| C、反应物的总能量低于生成物的总能量 |
| D、△t1=△t2 时,SO2 的转化率:a~b 段小于 b~c 段 |
 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题: