题目内容
在0.5mol Al2(SO4)3中含有Al3+的数目约( )个.
| A、3.01×1023 |
| B、6.02×1023 |
| C、0.5 |
| D、1 |
考点:物质的量的相关计算
专题:计算题
分析:根据N=nNA及硫酸铝的化学式组成计算出含有的铝离子数目.
解答:
解:0.5mol Al2(SO4)3中含有的铝离子的物质的量为:n(Al3+)=3n[Al2(SO4)3]=0.5mol×2=1mol,
1mol铝离子的数目为:N=6.02×1023×1=6.02×1023,
故选B.
1mol铝离子的数目为:N=6.02×1023×1=6.02×1023,
故选B.
点评:本题考查阿伏加德罗常数的有关计算,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
欲使醋酸溶液中的c(CH3COO-)增大且不放出气体,可向醋酸中加入少量固体( )
| A、NaOH |
| B、NaHCO3 |
| C、H2O |
| D、Mg |
下列化学反应过程中,△H小于零的是( )
| A、碳跟水蒸气反应制备水煤气 |
| B、氯化铵与熟石灰共热制备氨气 |
| C、高温煅烧石灰石 |
| D、锌跟稀硫酸反应制备氢气 |
设NA为阿伏伽德罗常数,下列说法正确的是( )
| A、高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B、室温下PH=13的NaOH溶液中,由水电离的OH-的数目为0.1NA |
| C、氢氧燃料电池正极消耗22.4L(标况)气体时,电路中通过的电子数目是2NA |
| D、18gH2O含有10NA个质子 |
下列说法正确的是( )
| A、可用丁达尔现象区分葡萄糖溶液和淀粉胶体 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4L任意比的氢气与氧气的混合气体中的分子总数均为2NA |
| B、标准状况下,22.4L水中含有2NA个O-H键 |
| C、足量铜与1L18mol?L-1浓硫酸反应可以生成SO2分子总数为9NA |
| D、1 L 0.1 mol?L-1乙酸溶液中H+数小于0.1NA |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、0.lmolNH4+离子中所含的电子数为1.1 NA |
| D、在标准状况下,11.2L H2O含有的分子数为0.5NA |
只含有一种元素的物质( )
| A、一定是一种单质 |
| B、可能是单质也可能是化合物 |
| C、一定是纯净物 |
| D、可能是纯净物也可能是混合物 |
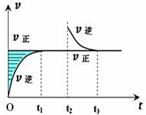 某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )
某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )| A、M和N在该条件下至少有一种是气态 |
| B、t2时刻后该可逆反应向逆反应方向进行,P的浓度一定减小 |
| C、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
| D、若在该温度下此反应平衡常数表达式为K=c(Q),则t1~t2时间段与t3时刻后的Q浓度不相等 |