题目内容
(11分)(1)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为 ,SO42-的物质的量浓度为 。
(2)在标准状况下,4 g H2、11.2 L O2、1 mL H2O中,所含分子数最多的是 ,含原子数最多的是 ,质量最大的是 ,体积最小的是 。
(3)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ,质量之比为 ,密度之比为 。
(1)a/54Vmol/L;a/18Vmol/L。(2)H2;H2;O2;H2O。
(3)1:1 1:1 5:3 4:11 4:11
【解析】考查一定物质的量浓度溶液的配制。
(1)Al3+的质量为a g,则铝离子的物质的量是a/27mol,所以根据化学式可知,Al2(SO4)3的物质的量是a/54mol,则硫酸铝的浓度是a/54Vmol/L;根据硫酸铝的化学式可知,SO42-的物质的量浓度为a/54Vmol/L×3/2=a/18Vmol/L。
(2)在标准状况下,4 g H2、11.2 L O2、1 mL H2O的物质的量分别是2mol、0.5mol和1/18mol。所以所含分子数最多的是氢气;含原子数最多的是氢气,含有4mol氢原子;氧气和水的质量分别是16g和1g,所以质量最大的是氧气;而体积最小的是水。(3)
(3)根据阿伏加德罗定律可知,在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为1︰1;物质的量之比也是1︰1;原子总数之比为1×5︰1×3=5︰3;质量之比为1×16︰1×44=4︰11;在相同条件下,气体的密度之比是摩尔质量之比,所以二者的密度之比是16×44=4︰11。

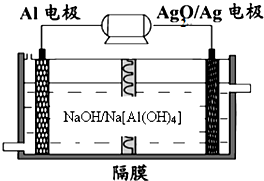 (2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
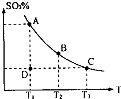 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: