题目内容
【题目】下列实验方案能达到目的的是
A.检验海带中是否含有碘元素:将干海带剪碎、灼烧成灰,用蒸馏水浸泡后过滤,向滤液中加入足量氯水,再加入![]() 滴淀粉溶液,观察是否变蓝色
滴淀粉溶液,观察是否变蓝色
B.检验牙膏中是否含有甘油:将牙膏样品加水搅拌、静置,向澄清液中加入新制的![]() 悬浊液,观察是否出现绛蓝色沉淀
悬浊液,观察是否出现绛蓝色沉淀
C.检验乙烯是否具有还原性:向乙醇中加入少量浓硫酸并加热至![]() ,将所得的气体通入酸性
,将所得的气体通入酸性![]() 溶液,观察紫色是否褪去
溶液,观察紫色是否褪去
D.检验火柴头中是否含有氯元素:将燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,向其中滴加![]() 溶液和稀硝酸,观察是否出现白色沉淀
溶液和稀硝酸,观察是否出现白色沉淀
【答案】D
【解析】
A.检验海带中是否含有碘元素:将干海带剪碎、灼烧成灰,用蒸馏水浸泡后过滤,向滤液中加入足量氯水,由于氯气可以将碘单质氧化,所以再加入![]() 滴淀粉溶液,不能观察到溶液变蓝色,选项A错误;
滴淀粉溶液,不能观察到溶液变蓝色,选项A错误;
B.检验牙膏中是否含有甘油:将牙膏样品加水搅拌、静置,向澄清液中加入新制的![]() 悬浊液,观察是否出现绛蓝色溶液而不是沉淀,选项B错误;
悬浊液,观察是否出现绛蓝色溶液而不是沉淀,选项B错误;
C.检验乙烯是否具有还原性:向乙醇中加入少量浓硫酸并加热至![]() ,将所得的气体通入酸性
,将所得的气体通入酸性![]() 溶液,由于乙烯气体中含有
溶液,由于乙烯气体中含有![]() 的杂质气体能使酸性
的杂质气体能使酸性![]() 溶液褪色,所以观察紫色褪去不能说明是乙烯的还原性,选项C错误;
溶液褪色,所以观察紫色褪去不能说明是乙烯的还原性,选项C错误;
D.检验火柴头中是否含有氯元素:将燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,向其中滴加![]() 溶液和稀硝酸,观察是否出现白色沉淀,符合氯离子的鉴定方法,故D正确。
溶液和稀硝酸,观察是否出现白色沉淀,符合氯离子的鉴定方法,故D正确。
答案选D。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
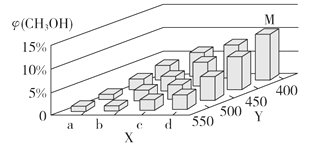
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
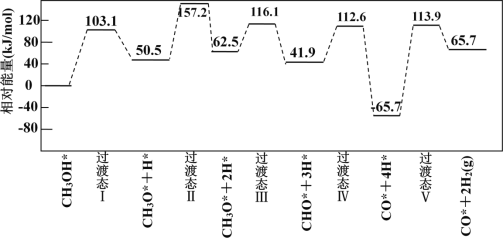
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究I-与Fe2+的还原性强弱 | 向FeCl3稀溶液中依次加入KI溶液、淀粉 |
B | 探究HPO42-在水溶液中的电离程度与水解程度的相对大小 | 测定0.1 mol·L-1NaH2PO4溶液的pH |
C | 配制0.1 mol·L-1邻苯二甲酸氢钾( | 称取5.1 g邻苯二甲酸氢钾于烧杯中,加入少量蒸馏水溶解,转移至500 mL容量瓶中定容 |
D | 比较CaCO3和CaSO4的Ksp大小 | 向澄清石灰水中滴入0.1 mol·L-1Na2CO3溶液至不再有沉淀产生,再滴加0.1 mol·L-1Na2SO4溶液 |
A.AB.BC.CD.D



