题目内容
【题目】锡酸钠晶体(Na2SnO33H2O2)在染料工业用作媒染剂。以锡渣废料(主要成分是SnO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体的工艺流程图如图:
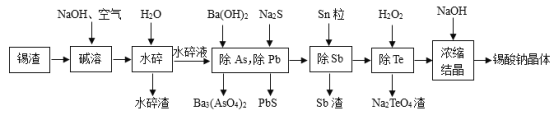
已知:水碎液中溶质的主要成分为Na2SnO3、Na3AsO4、Na3SbO4、Na2PbO2、Na2TeO3。
(1)“碱溶”时,SnO发生反应的化学方程式为___。
(2)工业上制备锡酸钠晶体(Na2SnO33H2O)时,会将“水碎渣”再次水洗,其目的是___。
(3) “除Sb”时发生反应的离子方程式为___。
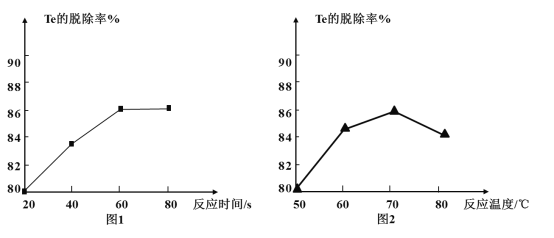
(4) “除Te”过程中氧化剂与还原剂的物质的量之比为___,该过程中反应时间、反应温度对Te的脱除率的影响关系如图,则70℃后随温度升高Te的脱除率下降的原因可能是___;“除Te”的最优反应时间和反应温度分别为___、___。
(5)已知锡酸钠的溶解度一般随着温度的升高而升高,则在“浓缩、结晶”时,加入NaOH的原因是___。
【答案】2SnO+O2+4NaOH==2Na2SnO3+2H2O 洗去水碎渣表面附着的锡酸钠,从而提高锡酸钠的产量 4![]() + 5Sn+H2O==4Sb+5
+ 5Sn+H2O==4Sb+5![]() +2OH- 1:1 H2O2受热分解 60min 70℃ 在NaOH存在的环境中,锡酸钠的溶解度随温度的升高而降低,从而有利于锡酸钠的结晶析出
+2OH- 1:1 H2O2受热分解 60min 70℃ 在NaOH存在的环境中,锡酸钠的溶解度随温度的升高而降低,从而有利于锡酸钠的结晶析出
【解析】
锡渣废料(主要成分是SnO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)在通入空气的情况下用NaOH碱溶,生成溶质的主要成分为Na2SnO3、Na3AsO4、Na3SbO4、Na2PbO2、Na2TeO3的水碎液,由后续操作可以看出,只有Fe的氧化物未溶解,所以Fe的氧化物就成为水碎渣;往水碎液中加入Ba(OH)2、Na2S,Na3AsO4、Na2PbO2分别转化为Ba3(AsO4)2、PbS沉淀;过滤后所得滤液中加入Sn粒,Na3SbO4转化为Sb,而Sn转化为Na2SnO3;过滤后滤液中加入H2O2,Na2TeO3被氧化为Na2TeO4沉淀;过滤后所得滤液经浓缩、结晶,加入NaOH,使Na2SnO3结晶析出,表明NaOH能降低Na2SnO3的溶解度,有利于Na2SnO3结晶析出。
(1)“碱溶”时,SnO被空气中的O2在NaOH存在的环境中氧化为Na2SnO3,发生反应的化学方程式为2SnO+O2+4NaOH==2Na2SnO3+2H2O;
(2)工业上制备锡酸钠晶体(Na2SnO33H2O)时,为提高所得产品的产量,会将“水碎渣”再次水洗,其目的是洗去水碎渣表面附着的锡酸钠,从而提高锡酸钠的产量;
(3)“除Sb”时,Na3SbO4与Sn在水溶液中发生反应生成Sb和Na2SnO3,发生反应的离子方程式为4![]() + 5Sn+H2O==4Sb+5
+ 5Sn+H2O==4Sb+5![]() +2OH-;
+2OH-;
(4)“除Te”过程中发生反应的化学方程式为Na2TeO3+H2O2=Na2TeO4↓+H2O,氧化剂与还原剂的物质的量之比为1:1;从图中可以看出,70℃后随温度升高Te的脱除率下降,则主要是H2O2热分解造成的,原因可能是H2O2受热分解;从图中可以看出,“除Te”的最优反应时间和反应温度分别为60min、70℃;
(5)加入的NaOH未参与反应,则必是影响锡酸钠的溶解度,所以在“浓缩、结晶”时,加入NaOH的原因是在NaOH存在的环境中,锡酸钠的溶解度随温度的升高而降低,从而有利于锡酸钠的结晶析出。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。