题目内容
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
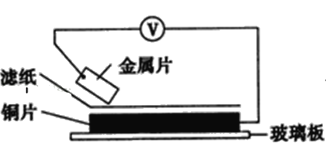
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
【答案】B
【解析】
A.电子由Cu流向乙,Cu为负极,乙为正极,金属乙的金属活泼性小于铜,所以金属乙不能从硫酸铜溶液中置换出铜,故A错误;
B.电子由甲流向Cu,甲为负极,Cu为正极,甲的金属活泼性大于铜,乙的金属活泼性小于铜,所以金属活泼性是甲大于乙,甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀,故B正确;
C.根据电子的流向,甲、丙、丁的金属活泼性均强于Cu,但是电压越大,金属性越强,所以活泼性是:丙>甲>丁,只有乙的金属活泼性弱于铜,所以在四种金属中乙的还原性最弱,故C错误;
D.金属活泼性是:丙>甲>丁,甲、丁若形成原电池时,活泼金属甲作负极,故D错误;
故选:B。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大