题目内容
为了测定某Cu—Ag合金的成分,将30.0g合金溶于80mL 13.5mol×L-1的浓HNO3中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0。假设反应后溶液的体积为80mL。试计算:(1)被还原的HNO3的物质的量。
(2)合金中银的质量分数。
答案:
解析:
解析:
| 解:(1)气体NOx(NO或NO2)的物质的量即被还原的HNO3的物质的量为
(2)∵ pH=0,∴c(H+)=1mol×L-1,反应的HNO3为:(13.5´0.080-1´0.080)mol=1mol 根据N原子守恒,设合金中Ag为xg。
解得 x=10.8g w(Ag)=
|

练习册系列答案
相关题目
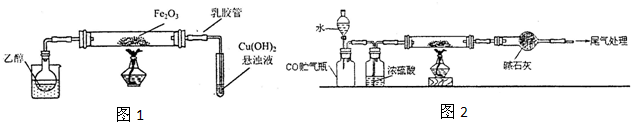
 某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。