题目内容
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。已知氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成![]()
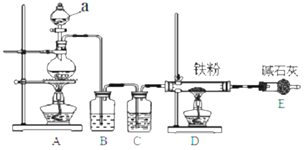
(1)某学习小组用如图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
①装置A 中仪器 a的名称是 ______ 。
②装置B的作用是 ______ ,C 中的试剂 ______ 。
③实验开始时先点燃 ______ 处酒精灯;装置 E的作用为 ______ 。
(2)工业上制备无水氯化铁的一种工艺流程如下:
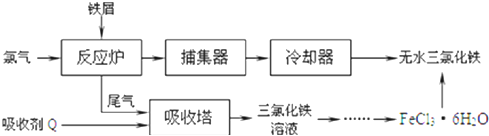
①吸收塔中发生反应的离子方程式为 ______
②简述由![]() 晶体得到无水氯化铁的操作: ______
晶体得到无水氯化铁的操作: ______
【答案】分液漏斗 除去氯气中的氯化氢 浓硫酸 A 阻止外界空气中的水蒸气进入D,吸收尾气 ![]() 在HCl气流中加热蒸干
在HCl气流中加热蒸干
【解析】
实验室制备无水氯化铁,需要先制取氯气,用A装置,根据题意B用于除去氯气中的氯化氢,C用于干燥氯气,由于无水氯化铁遇潮湿空气极易吸水生成![]() ,所以E防止空气中的水蒸气进入,同时吸收未反应的氯气,防止污染空气。实验时先点燃A处的酒精灯,使装置中充满氯气,再点燃D出的酒精灯,这样可以防止铁与氧气发生反应,据此分析。
,所以E防止空气中的水蒸气进入,同时吸收未反应的氯气,防止污染空气。实验时先点燃A处的酒精灯,使装置中充满氯气,再点燃D出的酒精灯,这样可以防止铁与氧气发生反应,据此分析。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
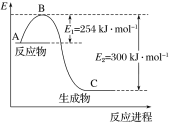
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。