题目内容
15. 氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )
氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )| A. | 反应O+O3=2O2的△H=E1-E3 | B. | O+O3=2O2是放热反应 | ||
| C. | △H=△H1+△H2 | D. | 反应O+O3=2O2的△H=E1-E2 |
分析 由图象可以看出,反应物O3+O总能量大于2O2的总能量,为放热反应,反应热为E3-E2,可利用盖斯定律计算的反应热△H.
解答 解:A.反应热等于生成物的总能量减去反应物的总能量,则反应O3+O=2O2的△H=E3-E1,故A错误;
B.由图象可以看出,反应物O3+O总能量大于2O2的总能量,为放热反应,故B正确;
C.已知:①O3+Cl=ClO+O2;△H1;②ClO+O=Cl+O2;△H2,利用盖斯定律将①+②可得:O3+O=2O2;△H=△H1+△H2,故C正确;
D.反应热等于生成物的总能量减去反应物的总能量,则反应O3+O=2O2的△H=E3-E1,故D错误.
故选:C.
点评 本题考查化学反应热的计算,题目难度中等,本题注意分析图象能量的关系,把握反应热的计算方法.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
3.氮的固定主要有三大途径,它们是生物固氮、大气固氮、工业固氮;氮肥主要有铵态氮肥、硝态氮肥和有机氮肥,目前氮肥中使用量最多的一种肥料是尿素;含氮、磷、钾三要素中的两种或两种以上的化学肥料称复合肥料.
10.下列有关热化学方程式及其叙述正确的是( )
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则其燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,则石墨的燃烧热为110,5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,故该反应一定能自发进行 | |
| D. | 热化学方程式中的化学计量数表示物质的量,可以是分数 |
20.下列反应的离子方程式书写正确的是( )
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2C1O+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 NH3•H2O+SO2=NH4++HSO3- | |
| D. | 硝酸铁溶液中加入过量氨水 Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ |
4.分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.下列关于“Na2SiO3”的分类不正确的是( )
| A. | 电解质 | B. | 弱酸盐 | C. | 强碱盐 | D. | 碱性氧化物 |
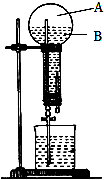 如图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B,请根据实验内容按要求填空:
如图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B,请根据实验内容按要求填空: NH4++OH-(用离子方程式表示);
NH4++OH-(用离子方程式表示);