题目内容
【题目】碘及其化合物在科研与生活中有很重要的作用。回答下列问题:
(1)碘可用作心脏起搏器电源——锂碘电池的材料,则碘电极是电池的______(填“正”或“负”)极。
(2)“加碘食盐”中含有少量的KIO3,向其中加入亚硫酸氢钠溶液,能产生使淀粉变蓝的物质,则该反应中氧化剂与还原剂的物质的量之比是_______________。
(3)碘单质与氢气反应的能量变化过程如图所示:

写出碘I2(s)转化成碘I2(g)的热化学方程式:__________________________________。
(4)在合成氨工业中用I2O5来测定CO的含量:5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s),在装有足量的I2O5固体的2L恒容密闭容器中通入2molCO发生上述反应,测得温度T1、T2下,一氧化碳的体积分数
5CO2(g)+I2(s),在装有足量的I2O5固体的2L恒容密闭容器中通入2molCO发生上述反应,测得温度T1、T2下,一氧化碳的体积分数![]() (CO)随时间t的变化曲线如图所示。回答下列问题:
(CO)随时间t的变化曲线如图所示。回答下列问题:
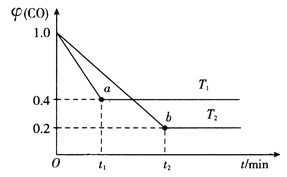
①温度T1下的平衡转化率![]() =________%,b点的平衡常数K2=__________。
=________%,b点的平衡常数K2=__________。
②在温度T2下,反应达到平衡后再充入适量的CO,重新达到平衡时;CO气体的转化率将_______(填“变大”“变小”或“不变”),该反应的△H_____(填“>”“<"或“=”)0。
③下列各种措施能提高该反应的CO转化率的是____________。
A.升温 B.加压 C.添加催化剂 D.移走部分CO2
【答案】 正 2:5 ![]() 60 1024 不变 < D
60 1024 不变 < D
【解析】(1)锂为活泼金属,在锂碘电池中充当负极,碘为正极,故答案为:正;
(2) KIO3与亚硫酸氢钠反应生成碘单质和硫酸钠,氧化剂为碘酸钾,还原剂为亚硫酸氢钠,根据得失电子守恒,反应中氧化剂与还原剂的物质的量之比=(6-4):(5-0)=2:5,故答案为:2:5;
(3)根据图像,1mol碘I2(s)转化成1mol碘I2(g),吸收328.5kJ-292.5 kJ =36kJ的能量,因此碘I2(s)转化成碘I2(g)的热化学方程式为I2(s) = I2(g) △H=+36kJ/mol,故答案为:I2(s) = I2(g) △H=+36kJ/mol;
(4)① 5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始(mol) 2 0
反应(mol) x x
平衡(mol)2-x x
则![]() =0.4,解得:x=1.2mol,则温度T1下的平衡转化率
=0.4,解得:x=1.2mol,则温度T1下的平衡转化率![]() =
=![]() ×100%=60%;同理b点平衡时CO为0.4mol,CO2为1.6mol,b点的平衡常数K2=
×100%=60%;同理b点平衡时CO为0.4mol,CO2为1.6mol,b点的平衡常数K2=![]() =1024,故答案为:60;1024;
=1024,故答案为:60;1024;
②温度不变,平衡常数不变,在温度T2下,反应达到平衡后再充入适量的CO,重新达到平衡时,CO气体的转化率不变,根据图像,T1>T2,温度由T1变成T2,为降低温度,CO的转化率增大,则平衡正向移动,正反应为放热反应,△H<0,故答案为:不变;<;
③A.该反应为放热反应,升温,平衡逆向移动,CO转化率减小,错误;B.加压,平衡不移动,CO转化率不变,错误;C.添加催化剂,平衡不移动,CO转化率不变,错误;D.移走部分CO2,平衡正向移动,CO转化率增大,正确;故选D。

 阅读快车系列答案
阅读快车系列答案