题目内容
下列说法正确的是( )
| A、非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B、常温下,1mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C、在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D、硫酸铜溶液显酸性的原因:Cu2++2H2O═Cu(OH)2↓+2H+ |
考点:氯气的化学性质,盐类水解的应用,物质的分离、提纯和除杂
专题:元素及其化合物
分析:A.非金属单质在反应中可能作还原剂;
B.氯气与NaOH反应,氯气既是氧化剂又是还原剂;
C.乙酸、乙醇均与乙酸乙酯混溶;
D.铜离子水解显酸性,为可逆反应不生成沉淀.
B.氯气与NaOH反应,氯气既是氧化剂又是还原剂;
C.乙酸、乙醇均与乙酸乙酯混溶;
D.铜离子水解显酸性,为可逆反应不生成沉淀.
解答:
解:A.非金属单质在反应中可能作还原剂,如氯气与NaOH的反应中,氯气为氧化剂、还原剂,故A错误;
B.常温下,1mol氯气和足量稀NaOH溶液完全反应,生成NaCl、NaClO,氯气既是氧化剂又是还原剂,转移1mol电子,故B正确;
C.乙酸、乙醇均与乙酸乙酯混溶,不能除杂,应利用饱和碳酸钠溶液来除杂,故C错误;
D.铜离子水解显酸性,为可逆反应不生成沉淀,则硫酸铜溶液显酸性的原因为Cu2++2H2O?Cu(OH)2+2H+,故D错误;
故选B.
B.常温下,1mol氯气和足量稀NaOH溶液完全反应,生成NaCl、NaClO,氯气既是氧化剂又是还原剂,转移1mol电子,故B正确;
C.乙酸、乙醇均与乙酸乙酯混溶,不能除杂,应利用饱和碳酸钠溶液来除杂,故C错误;
D.铜离子水解显酸性,为可逆反应不生成沉淀,则硫酸铜溶液显酸性的原因为Cu2++2H2O?Cu(OH)2+2H+,故D错误;
故选B.
点评:本题考查较综合,涉及氧化还原反应、氯气的性质、混合物分离提纯及盐类水解等,注重基础知识的考查,题目难度不大,选项C为易错点.

练习册系列答案
相关题目
下列各组微粒半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
C5H12有3种不同结构:甲、CH3(CH2)3CH3,乙、CH3CH(CH3)CH2CH3 丙、C(CH3)4,下列相关叙述正确的是( )
| A、甲、乙、丙属同系物,均可与氯气、溴蒸气发生取代反应 |
| B、C5H12表示一种纯净物 |
| C、甲、乙、丙中,丙的沸点最低 |
| D、丙有3种不同沸点的二氯取代物 |
如图是元素周期表的一部分,有关说法不正确的是( )


| A、b、d、f四种元素的原子半径:b>f>d |
| B、元素b的单质不能与酸性氧化物发生化学反应 |
| C、元素c的氧化物既能与酸反应,又能与碱反应 |
| D、a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
在澳大利业一块栽种甘蔗的酸性红土地里,有一些水泥洒落在这块田地里,使得甘蔗产量突然提高了50%.已知水泥中含有氧化钙、氧化镁、氧化钾等物质,下列有关甘蔗增产的解释较为合理的是( )
| A、水泥能降低病虫害的发生 |
| B、水泥造成了土壤的板结 |
| C、水泥中氧化钙、氧化镁、氧化钾溶于水变成碱性物质,与土壤中的酸中和,改良了土壤 |
| D、水泥使土壤的酸性增强 |
(双项)下列说法正确的是( )
| A、氢键是一种化学键 |
| B、氢键使物质具有较高的熔、沸点 |
| C、能与水分子形成氢键的物质易溶于水 |
| D、水结成冰体积膨胀与氢键无关 |
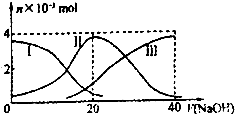 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大 |
| C、欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D、向NaHA溶液加人水的过程中,pH可能增大也可能减小 |