��Ŀ����
����Ŀ�����Ƶı�����ˮ�к��ж���������ijУ��ѧ�о���ѧϰС���ͬѧΪ̽�������ʣ���������ʵ�飬���������ɡ�
��1��������ʹʪ��ĺ�ɫ������ɫ��ʹ����ɫ�����Ļ�ѧʽ��__________��
��2������ˮ����һ��ʱ�����Һ��ɫ��dz���йط�Ӧ�Ļ�ѧ����ʽΪ__________��__________��
��3�����Ƶı�����ˮ��̼��Ƶķ�Ӧ����ȡ��ŨHClO ��Һ �� �� �� ֮һ��
ʵ��һ �����о���

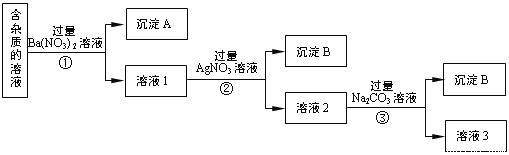
������ͼ��ʾ�����Թ��м�������Ŀ�״̼��ƣ��ټ���Լ20 mL���Ƶı�����ˮ����ַ�Ӧ�����������ݲ�������Һdz����ɫ��ȥ��
�������ˣ�����Һ������ɫ�����ϣ����������ˮ��Ư���Ը�ǿ��
����Ϊ��ȷ����Ӧ�������Һ��Ϊ���ݣ��ֱ��������ʵ����
��һ����ʯ��ˮ��ϣ���������������ɫ����;
�ڶ�����ϡ�����ϣ���������������ɫ���壬
�������ݼ��ȣ��۲쵽��Һ��������д�����ɫ���������
����⣬����ʵ���в�������ɫ�����ΪCO2��
����Ӧ�����õ���ҺƯ������ǿ��ԭ����__________________________________________________��
����������ʵ�����֪������������Һ�е����ʳ�CaCl2��HClO�⣬����__________��
ʵ��� �����о���
������A�ڣ�������������ס�Ŀ�״̼���(����)��150 mL���Ƶı�����ˮ������ͼ��ʾװ��ʵ��(ʵ��ǰ����B�г����˱���NaHCO3��Һ)�������ٲ������ݺ�������������ʣ���̼������Һ�棬�ܷ���ټ�����ƿ�е�Һ����ֱ������B�е����岻������(������HClO�ķֽ�)��

������A������Ϊ__________��
��ȷ��������B�����������ʵ�����������������a���ȴ�����A��ȴ������;b��____________��c�� ƽ����̶������е�Һ�������
��ʵ������������B���ռ�������������ڱ�״����Ϊ168mL����150mL ���Ƶı�����ˮ�����̼�����ȫ��Ӧ��������Һ��HClO�����ʵ���Ũ��Ϊ__________��(��Ӧǰ����Һ����仯���Բ���)
���𰸡� HClO Cl2+ H2O![]() HCl+ HClO 2HClO
HCl+ HClO 2HClO![]() 2HCl+O2 �� CaCO3 ������ˮ�е�HCl��ʹ��ӦCl2+H2O
2HCl+O2 �� CaCO3 ������ˮ�е�HCl��ʹ��ӦCl2+H2O![]() HCl+HClO�Ļ�ѧƽ�������ƶ���HClOŨ������ Ca(HCO3)2 Բ����ƿ �����ƶ�����B������B��Һ����ˮ���е�Һ����ƽ 0.05 mol��L-1
HCl+HClO�Ļ�ѧƽ�������ƶ���HClOŨ������ Ca(HCO3)2 Բ����ƿ �����ƶ�����B������B��Һ����ˮ���е�Һ����ƽ 0.05 mol��L-1
����������1����������ˮ����ˮ��ӦCl2+H2O![]() HCl+HClO������HClO����Ư���ԣ���ʹʪ��ĺ�ɫ������ɫ����ʹ����ɫ�����Ļ�ѧʽ��HClO����2������ˮ����һ��ʱ�����Һ��ɫ��dz������ΪHClO���ȶ�������ֽ�����HCl��O2��HClOŨ�Ƚ��ͣ�ƽ��Cl2+H2O
HCl+HClO������HClO����Ư���ԣ���ʹʪ��ĺ�ɫ������ɫ����ʹ����ɫ�����Ļ�ѧʽ��HClO����2������ˮ����һ��ʱ�����Һ��ɫ��dz������ΪHClO���ȶ�������ֽ�����HCl��O2��HClOŨ�Ƚ��ͣ�ƽ��Cl2+H2O![]() HCl+HClO�����ƶ����������ģ���Һ��ɫ��dz���йط�Ӧ�Ļ�ѧ����ʽΪ��Cl2+H2O
HCl+HClO�����ƶ����������ģ���Һ��ɫ��dz���йط�Ӧ�Ļ�ѧ����ʽΪ��Cl2+H2O![]() HCl+HClO��2HClO
HCl+HClO��2HClO![]() 2HCl+O2������3����CaCO3������ˮ�е�HCl��ʹ��ӦCl2+H2O
2HCl+O2������3����CaCO3������ˮ�е�HCl��ʹ��ӦCl2+H2O![]() HCl+HClO�Ļ�ѧƽ�������ƶ���HClOŨ������Ӧ����������Ϊ������̼��������̼��Ʒ�Ӧ���ã�����������̼����ˮ�����ԣ������˴�����ĵ��룬ʹ��Һ�д�����Ũ�ȸ��ߵĴ����ᣬ�����Һ������ɫ�����ϣ����������ˮ��Ư���Ը�ǿ����������ˮ��ӦCl2+H2O
HCl+HClO�Ļ�ѧƽ�������ƶ���HClOŨ������Ӧ����������Ϊ������̼��������̼��Ʒ�Ӧ���ã�����������̼����ˮ�����ԣ������˴�����ĵ��룬ʹ��Һ�д�����Ũ�ȸ��ߵĴ����ᣬ�����Һ������ɫ�����ϣ����������ˮ��Ư���Ը�ǿ����������ˮ��ӦCl2+H2O![]() HCl+HClO�����ɣ���Ϊ̼����ǹ����ģ����ҷ�Ӧ���ж�����̼���ɣ����̼��ƺͶ�����̼��ˮ��Ӧ�����˿�����ˮ��̼�����CaCO3+CO2+H2O=Ca(HCO3)2����˵ڶ�����ϡ������Ca(HCO3)2+2HCl=CaCl2+2CO2��+2H2O�����Բ���������Һ�е����ʳ�CaCl2��HClO�⣬����Ca(HCO3)2��������A������ΪԲ����ƿ����ȷ��������B�����������ʵ�����������������a���ȴ�����A��ȴ��������b�������ƶ�����B������B��Һ����ˮ���е�Һ����ƽ��c��ƽ����̶������е�Һ���������ʵ������и��ݷ�ӦCl2+H2O
HCl+HClO�����ɣ���Ϊ̼����ǹ����ģ����ҷ�Ӧ���ж�����̼���ɣ����̼��ƺͶ�����̼��ˮ��Ӧ�����˿�����ˮ��̼�����CaCO3+CO2+H2O=Ca(HCO3)2����˵ڶ�����ϡ������Ca(HCO3)2+2HCl=CaCl2+2CO2��+2H2O�����Բ���������Һ�е����ʳ�CaCl2��HClO�⣬����Ca(HCO3)2��������A������ΪԲ����ƿ����ȷ��������B�����������ʵ�����������������a���ȴ�����A��ȴ��������b�������ƶ�����B������B��Һ����ˮ���е�Һ����ƽ��c��ƽ����̶������е�Һ���������ʵ������и��ݷ�ӦCl2+H2O![]() HCl+HClO��2HCl+2CaCO3=Ca(HCO3)2+ CaCl2��Ca(HCO3)2+2HCl=CaCl2+2CO2��+2H2O��֪��n(HClO)=n(HCl)=2n(CO2)=
HCl+HClO��2HCl+2CaCO3=Ca(HCO3)2+ CaCl2��Ca(HCO3)2+2HCl=CaCl2+2CO2��+2H2O��֪��n(HClO)=n(HCl)=2n(CO2)= ![]() =0.015mol��c(HClO)=
=0.015mol��c(HClO)= ![]() =0.1mol/L��
=0.1mol/L��

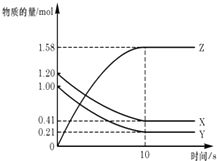
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/molL��1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/molL��1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ�������
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50%
B.��Ӧ�ɱ�ʾΪX+3Y2Z����ƽ�ⳣ��Ϊ1600
C.����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
D.�ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��