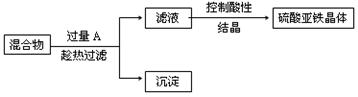
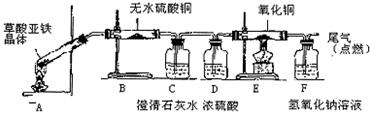
题目内容
(1)若从中取出50mL,其物质的量浓度为
(2)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为
(1)根据溶液浓度的均一性,所取溶液浓度与原溶液浓度一样,与所取溶液的体积大小无关,从而判断50mL溶液的浓度;同一溶液,溶质的浓度相同,溶质的质量与溶液的体积成正比,据此计算溶质的质量.
(2)根据溶液稀释前后溶质的物质的量不变计算稀释后溶液的物质的量浓度,然后根据溶质的分子式与离子的关系计算离子的浓度.
| m |
| M |
| 14.2g |
| 142g/mol |
| n |
| V |
| 0.1mol |
| 0.5L |
(1)根据溶液浓度的均一性,所取溶液浓度与原溶液浓度一样,与所取溶液的体积大小无关,故答案为:0.2mol/L;
溶液浓度相同,溶质的质量与所取溶液的体积成正比,设50mL溶液中溶质的质量为xg.
所以比例式为:14.2g:xg=0.5L:0.05L
x=1.42
故答案为:1.42g.
(2)溶液稀释前后溶质的物质的量不变得,
C1V1=C2V2
C2=
| C1V1 |
| V2 |
| 0.2mol/L×0.05L |
| 0.1L |
每个硫酸钠分子中含有2个Na+和1个SO42-离子,所以Na+的物质的量浓度是硫酸钠的2倍,SO42-的物质的量浓度与硫酸钠的物质的量浓度相等,故答案为:0.2 mol/L;0.1mol/L.

(12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案: 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:
(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② 。
(3)请你对其中一种可能进行实验验证:________________________________
实验方案(用文字述):________________________________________________,
根据预期现象判断结论:________________________________________________________。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
| 序号 | V(KMnO4)初 | V(KMnO4)终 | V(KMnO4) |
| 1 | 2.24mL | 14.25mL | 12.01mL |
| 2 | 0.30mL | 12.72mL | 12.42mL |
| 3 | 0.50mL | 12.53 | 12.03mL |
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。
(12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案:
 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:

(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② 。
(3)请你对其中一种可能进行实验验证:________________________________
实验方案(用文字述):________________________________________________ ,
根据预期现象判断结论:________________________________________________________ 。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
|
序号 |
V(KMnO4)初 |
V(KMnO4)终 |
V(KMnO4) |
|
1 |
2.24mL |
14.25mL |
12.01mL |
|
2 |
0.30mL |
12.72mL |
12.42mL |
|
3 |
0.50mL |
12.53 |
12.03mL |
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。