��Ŀ����
��ʢ��amol NO2��bmol NO����״���£����������Թܵ���������ʢ��ˮ��ˮ���У���ͨ��b mol O2����ַ�Ӧ���Թ���ʣ�������ijɷּ����ʵ���ȡ����a��b�Ĺ�ϵ���������ж���ȷ����
������NO����a��b����ʣ����������ʵ���Ϊ
������O2����a��b����ʣ����������ʵ���Ϊ
����������ʣ�࣬��a=b����������Һ�����ʵ���Ũ��Ϊ mol��L-1��
mol��L-1��
- A.ֻ�Т���ȷ
- B.ֻ�Т���ȷ
- C.�٢ڢ۶�����ȷ
- D.�٢ڢ۶���ȷ
B
������������NO���������������ֻ������Ӧ4NO2+O2+2H2O=4HNO3��
������Ӧ4NO2+O2+2H2O=4HNO3��3NO2+H2O=2HNO3+NO��
������Ӧ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3��NO��ʣ�ࣻ
�ݴ����ۼ����жϣ�
�ڡ�����O2������4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��NO��ȫ��Ӧ����a��b��ʾ��Ҫ���������ʵ������ٽ�����������ʵ���ȷ����ϵ������ʣ�����������ʵ�����
�ۡ���������ʣ�࣬����4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����a��b��ʾ��Ҫ���������ʵ������ٽ�����������ʵ���ȷ����ϵ������NԪ���غ�n��HNO3��=n��NO��+n��NO2������Һ�������NO��NO2�����֮�ͣ�����n= ���������Ũ�ȣ�
���������Ũ�ȣ�
��𣺢�����NO�������������
��ֻ������Ӧ4NO2+O2+2H2O=4HNO3����4bmol=amol����a=4b��NOδ��Ӧ��ʣ��NOΪbmol��
������Ӧ4NO2+O2+2H2O=4HNO3��3NO2+H2O=2HNO3+NO����4bmol��amol����a��4b����ˮ��Ӧ��NO2Ϊ��a-4b��mol
ʣ��NOΪbmol+ ��a-4b��mol=
��a-4b��mol= ��a-b��mol��
��a-b��mol��
������Ӧ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��Ҫ������Ϊ amol����NO��Ӧ������Ϊbmol-
amol����NO��Ӧ������Ϊbmol- amol��NO��ȫ��Ӧ��Ҫ����Ϊ
amol��NO��ȫ��Ӧ��Ҫ����Ϊ bmol������NOʣ�࣬��
bmol������NOʣ�࣬�� bmol��bmol-
bmol��bmol- amol������a��b��
amol������a��b��
��b- a��mol������Ӧ��NOΪ
a��mol������Ӧ��NOΪ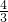 ��b-
��b- a��mol����ʣ��NOΪbmol-
a��mol����ʣ��NOΪbmol-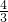 ��b-
��b- a��mol=
a��mol= ��a-b��mol��
��a-b��mol��
�ʢٴ���
�ڡ�����O2������4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��NO��ȫ��Ӧ����NO2��Ҫ������Ϊ amol��NO��Ҫ����Ϊ
amol��NO��Ҫ����Ϊ bmol����Ϊ
bmol����Ϊ amol+
amol+ bmol��bmol��������a��b��ʣ������Ϊbmol-��
bmol��bmol��������a��b��ʣ������Ϊbmol-�� amol+
amol+ bmol��=
bmol��= ��b-a��mol���ʢ���ȷ
��b-a��mol���ʢ���ȷ
��
�ۡ���������ʣ�࣬����4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��Ҫ������Ϊ amol��NO��Ҫ����Ϊ
amol��NO��Ҫ����Ϊ bmol
bmol
��Ϊ amol+
amol+ bmol=bmol��������a=b������NԪ���غ�n��HNO3��=n��NO��+n��NO2��=��a+b��mol����Һ�������NO��NO2�����֮��Ϊ��a+b��mol��22.4L/mol=22.4��a+b���������Ũ��Ϊ
bmol=bmol��������a=b������NԪ���غ�n��HNO3��=n��NO��+n��NO2��=��a+b��mol����Һ�������NO��NO2�����֮��Ϊ��a+b��mol��22.4L/mol=22.4��a+b���������Ũ��Ϊ =
=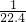 mol/L���ʢ۴���
mol/L���ʢ۴���
��ѡB��
���������⿼�����ʵ������йؼ��㣬ע��Ҫ������������ۣ��ѶȽϴ�
������������NO���������������ֻ������Ӧ4NO2+O2+2H2O=4HNO3��
������Ӧ4NO2+O2+2H2O=4HNO3��3NO2+H2O=2HNO3+NO��
������Ӧ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3��NO��ʣ�ࣻ
�ݴ����ۼ����жϣ�
�ڡ�����O2������4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��NO��ȫ��Ӧ����a��b��ʾ��Ҫ���������ʵ������ٽ�����������ʵ���ȷ����ϵ������ʣ�����������ʵ�����
�ۡ���������ʣ�࣬����4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����a��b��ʾ��Ҫ���������ʵ������ٽ�����������ʵ���ȷ����ϵ������NԪ���غ�n��HNO3��=n��NO��+n��NO2������Һ�������NO��NO2�����֮�ͣ�����n=
 ���������Ũ�ȣ�
���������Ũ�ȣ���𣺢�����NO�������������
��ֻ������Ӧ4NO2+O2+2H2O=4HNO3����4bmol=amol����a=4b��NOδ��Ӧ��ʣ��NOΪbmol��
������Ӧ4NO2+O2+2H2O=4HNO3��3NO2+H2O=2HNO3+NO����4bmol��amol����a��4b����ˮ��Ӧ��NO2Ϊ��a-4b��mol
ʣ��NOΪbmol+
 ��a-4b��mol=
��a-4b��mol= ��a-b��mol��
��a-b��mol��������Ӧ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��Ҫ������Ϊ
 amol����NO��Ӧ������Ϊbmol-
amol����NO��Ӧ������Ϊbmol- amol��NO��ȫ��Ӧ��Ҫ����Ϊ
amol��NO��ȫ��Ӧ��Ҫ����Ϊ bmol������NOʣ�࣬��
bmol������NOʣ�࣬�� bmol��bmol-
bmol��bmol- amol������a��b��
amol������a��b����b-
 a��mol������Ӧ��NOΪ
a��mol������Ӧ��NOΪ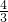 ��b-
��b- a��mol����ʣ��NOΪbmol-
a��mol����ʣ��NOΪbmol-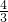 ��b-
��b- a��mol=
a��mol= ��a-b��mol��
��a-b��mol���ʢٴ���
�ڡ�����O2������4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��NO��ȫ��Ӧ����NO2��Ҫ������Ϊ
 amol��NO��Ҫ����Ϊ
amol��NO��Ҫ����Ϊ bmol����Ϊ
bmol����Ϊ amol+
amol+ bmol��bmol��������a��b��ʣ������Ϊbmol-��
bmol��bmol��������a��b��ʣ������Ϊbmol-�� amol+
amol+ bmol��=
bmol��= ��b-a��mol���ʢ���ȷ
��b-a��mol���ʢ���ȷ��
�ۡ���������ʣ�࣬����4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O�T4HNO3����NO2��Ҫ������Ϊ
 amol��NO��Ҫ����Ϊ
amol��NO��Ҫ����Ϊ bmol
bmol��Ϊ
 amol+
amol+ bmol=bmol��������a=b������NԪ���غ�n��HNO3��=n��NO��+n��NO2��=��a+b��mol����Һ�������NO��NO2�����֮��Ϊ��a+b��mol��22.4L/mol=22.4��a+b���������Ũ��Ϊ
bmol=bmol��������a=b������NԪ���غ�n��HNO3��=n��NO��+n��NO2��=��a+b��mol����Һ�������NO��NO2�����֮��Ϊ��a+b��mol��22.4L/mol=22.4��a+b���������Ũ��Ϊ =
=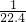 mol/L���ʢ۴���
mol/L���ʢ۴�����ѡB��
���������⿼�����ʵ������йؼ��㣬ע��Ҫ������������ۣ��ѶȽϴ�

��ϰ��ϵ�д�
 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
�����Ŀ


 mol��L-1��
mol��L-1��