题目内容
11.1H${\;}_{2}^{16}$O、2H${\;}_{2}^{17}$O、3H${\;}_{2}^{18}$O、1H35Cl、2H37Cl五种分子中共存在3种元素,8种原子.分析 元素是具有相同核电荷数的一类原子,核素是具有一定数目的质子和一定数目的中子的一种原子.
解答 解:在1H${\;}_{2}^{16}$O、2H${\;}_{2}^{17}$O、3H${\;}_{2}^{18}$O、1H35Cl、2H37Cl有氧元素、氢元素和氯元素三种,这三种元素中具有一定数目的质子数和一定数目的中子数均属于核素,有1H、2H、3H、16O、17O、18O、35Cl、37Cl八种核素;故答案为:3;8.
点评 本题考查了元素、核素的概念,较简单,注意同种元素的不同核素即是不同原子.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
1.在常温下,下列溶液呈酸性的是( )
| A. | NaCl溶液 | B. | NH4Cl溶液 | C. | Na2CO3溶液 | D. | CH3COONa溶液 |
2.某有机物的结构简式如图所示.下列有关该物质的说法正确的是( )


| A. | 该物质的分子式为C21H25O5 | |
| B. | 该物质含有四种含氧官能团 | |
| C. | 1 mol该物质在一定条件下最多可以和5mol H2反应 | |
| D. | 1 mol该物质最多能与2 mol NaOH反应 |
19.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2L N2含有分子数为0.5NA | |
| C. | 18 g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1 Na2SO4溶液中,Na+和SO${\;}_{4}^{2-}$的离子总数是0.3NA |
6.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Na+、HCO3-、SO42- | B. | Ba2+、NO3-、SO42-、K+ | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Mg2+、Fe3+、Cl-、OH- |
12.下列气体主要成分不是甲烷的是( )
| A. | 天然气 | B. | 沼气 | C. | 煤矿坑道气 | D. | 液化石油气 |
9.水是最常用的溶剂,许多化学反应都需要在水溶液中进行.请仔细分析并回答下列各题.
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:
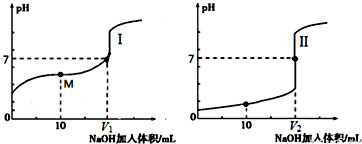
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为酚酞,符合其滴定曲线的是I(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中v1和v2大小的比较:v1<v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25℃):
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
①请结合化学用语和必要的文字解释步骤2 现象出现的原因:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,Fe3+与SCN-结合生成Fe(SCN)3从而显红色.
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀,溶液红色变浅.
③写出步骤4 中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:

①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为酚酞,符合其滴定曲线的是I(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中v1和v2大小的比较:v1<v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25℃):
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
①请结合化学用语和必要的文字解释步骤2 现象出现的原因:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,Fe3+与SCN-结合生成Fe(SCN)3从而显红色.
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀,溶液红色变浅.
③写出步骤4 中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
10.己烯雌酚是一种激素类药物,结构如下.下列有关叙述中不正确的是( )
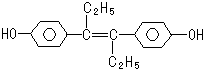

| A. | 它易溶于有机溶剂 | |
| B. | 该有机物可与少量Na2CO3反应放出CO2气体 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下: