题目内容
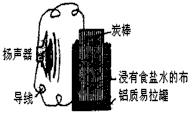
 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )分析:A、原电池中电流流向是从正极流向负极;
B、装置中铝做原电池负极失电子发生氧化反应;
C、负极是铝失电子生成铝离子,正极是氧气得到电子生成氢氧根离子,结合电子守恒写出;
D、碳棒做原电池正极,氧气得到电子发生还原反应.
B、装置中铝做原电池负极失电子发生氧化反应;
C、负极是铝失电子生成铝离子,正极是氧气得到电子生成氢氧根离子,结合电子守恒写出;
D、碳棒做原电池正极,氧气得到电子发生还原反应.
解答:解:A、原电池中电流流向是从正极流向负极,电流方向为:炭棒→导线→扬声器→导线→铝质易拉罐,故A错误;
B、铝做原电池负极失电子发生氧化反应被腐蚀,故B正确;
C、负极电极反应Al-3e-=Al3+,正极电极反应O2+2H2O+4e-=4OH-,电子守恒后合并得到电池总反应为:4Al+3O2+6H2O=4Al(OH)3,故C正确;
D、炭棒上发生的主要反应为O2+2H2O+4e-=4OH-,故D错误;
故选BC.
B、铝做原电池负极失电子发生氧化反应被腐蚀,故B正确;
C、负极电极反应Al-3e-=Al3+,正极电极反应O2+2H2O+4e-=4OH-,电子守恒后合并得到电池总反应为:4Al+3O2+6H2O=4Al(OH)3,故C正确;
D、炭棒上发生的主要反应为O2+2H2O+4e-=4OH-,故D错误;
故选BC.
点评:本题考查原电池原理的分析判断,电极反应的书写方法,电流方向,电子流向分析是关键,题目难度中等.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目