题目内容
加入适量0.1mol/L FeCl3溶液于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图a所示.
(1)①写出H2O2在FeCl3作用下发生反应的化学方程式 .
②A、B、C、D各点反应速率最快的是 .
③解释反应速率变化的原因 .
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,甲、乙两位同学分别设计了如图b所示的实验.
①甲、乙两同学可通过 定性比较得出结论.
②观察两同学的方案,你认为 (填“甲”或“乙”)更合理.理由是 .

(1)①写出H2O2在FeCl3作用下发生反应的化学方程式
②A、B、C、D各点反应速率最快的是
③解释反应速率变化的原因
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,甲、乙两位同学分别设计了如图b所示的实验.
①甲、乙两同学可通过
②观察两同学的方案,你认为
考点:化学反应速率的影响因素
专题:实验设计题
分析:(1)①双氧水在催化剂的作用下分解为水和氧气;
②根据v=
比较反应速率快慢;
③物质的浓度与反应速率成正比;
(2)①比较反应速率的大小可通过生成气泡的快慢来判断;
②比较金属阳离子的催化效果要排斥阴离子的干扰.
②根据v=
| △V |
| △t |
③物质的浓度与反应速率成正比;
(2)①比较反应速率的大小可通过生成气泡的快慢来判断;
②比较金属阳离子的催化效果要排斥阴离子的干扰.
解答:
解:(1)①双氧水在催化剂氯化铁的作用下分解为水和氧气,即2H2O2
2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑;
②根据图象结合v=
知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A;
③反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
故答案为:随着反应的进行,浓度减小,反应速率减慢;
(2)①该反应中产生气体,可根据生成气泡的快慢判断,故答案为:反应产生气泡快慢或反应完成的先后或试管壁的冷热程度;
②氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,
故答案为:甲;控制阴离子相同,排除阴离子的干扰.
| ||
| ||
②根据图象结合v=
| △V |
| △t |
③反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
故答案为:随着反应的进行,浓度减小,反应速率减慢;
(2)①该反应中产生气体,可根据生成气泡的快慢判断,故答案为:反应产生气泡快慢或反应完成的先后或试管壁的冷热程度;
②氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,
故答案为:甲;控制阴离子相同,排除阴离子的干扰.
点评:本题考查实验方案设计,根据v=
来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,难度中等.
| △V |
| △t |

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
下列有机物的命名正确的是( )
| A、3,3-二甲基丁烷 |
| B、3-甲基-2-丁烯 |
| C、2-乙基丁烷 |
| D、2,3,5-三甲基己烷 |
下列叙述正确的是( )
| A、用电解法精炼粗铜时,粗铜做阴极 |
| B、铜-锌原电池工作时,负极从外电路得到电子 |
| C、用惰性电极电解饱和氯化钠溶液时,在标准状况下,两极产生的气体体积比为1:1 |
| D、用铂电极电解NaOH稀溶液一段时间后,溶液的质量分数不变 |
下列各项数据中,其比值为2:1的是( )
| A、Na2S溶液中c(Na+)与c(S2-)之比 |
| B、相同温度下,0.2mol/LCH3COOH溶液与0.1mol/LCH3COOH溶液中c(H+)之比 |
| C、pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO4-)之比 |
| D、pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH?)之比 |
工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH=10.7左右时,所得产物中氮气和氨气的物质的量之比为4:1,则除去含0.1mol NO3-的废水所消耗铝粉的质量至少为( )
| A、3.53g |
| B、4.80g |
| C、5.04g |
| D、8.64g |

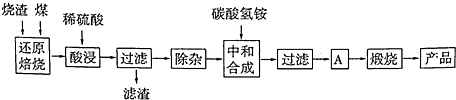

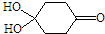 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
 ).
). )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为