题目内容
【题目】下列变化为放热反应的是( )
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应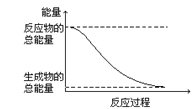
【答案】D
【解析】
A. H2O(g)=H2O(l) 不是化学反应,所以不是放热反应,故不选A;
B. 2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol,焓变大于0,为吸热反应,故不选B;
C. 形成化学键时共放出能量862 kJ,但不知断键时吸收的热量多少,二者的差值无法计算,所以不能判断反应是否是放热反应,故不选C;
D. 根据图示,反应物的总能量大于生成物总能量,一定为放热反应,故选D;
答案选D。

【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)盛装0.2000 mol/L盐酸标准液应该用__式滴定管。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视__;终点判断方法:_________________
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:_____
(4)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20. 00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为______mol/L(保留四位有效数字)
(5)若滴定时锥形瓶未干燥,则测定结果________;若滴定前平视读数,滴定终点时仰视读数,则会使所测碱的浓度值________。(填“无影响”、“偏高”或“偏低”)。