题目内容
3.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)该同学推测的四种离子浓度大小关系,肯定不可能存在的是②(填序号).
(2)若溶液中只溶解了一种溶质,该溶质的名称是氯化铵,上述离子浓度大小顺序关系中正确的是①(填序号).
(3)若上述关系中④是正确的,则溶液中溶质的化学式是HCl和NH4Cl.
(4)若该溶液由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>、<、=”)<c(NH3•H2O).
分析 (1)溶液中存在电荷守恒,根据电荷守恒判断;
(2)若溶液中只溶解了一种溶质,该溶质是NH4Cl,氯化铵为强酸弱碱盐,其溶液呈酸性,溶液中存在电荷守恒;
(3)若上述关系中c(Cl-)>c(H+)>c(NH4+)>c(OH-)是正确的,溶液呈酸性,则溶液中的溶质为氯化铵和HCl;
(4)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,氯化铵溶液呈碱性,要使氨水和稀盐酸混合溶液呈中性,则氨水物质的量应该稍微大些.
解答 解:(1)如果溶液呈碱性,则c(OH-)>c(H+),溶液中存在电荷守恒,根据电荷守恒得c(Cl-)<c(NH4+),所以②错误,故答案为:②;
(2)水中含有氢离子和氢氧根离子,若溶液中只溶解了一种溶质,该溶质是NH4Cl,氯化铵为强酸弱碱盐,其溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Cl-)>c(NH4+),盐类水解较微弱,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:氯化铵;①;
(3)若上述关系中c(Cl-)>c(H+)>c(NH4+)>c(OH-)是正确的,溶液呈酸性,则溶液中的溶质为氯化铵和HCl,故答案为:HCl和NH4Cl;
(4)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,氯化铵溶液呈碱性,要使氨水和稀盐酸混合溶液呈中性,则氨水物质的量应该稍微大些,因为二者体积相等,所以c(HCl)<c(NH3•H2O),故答案为:<.
点评 本题以离子浓度大小比较为载体考查弱电解质的电离及盐类水解,明确溶液中溶质及其性质是解本题关键,知道任何电解质溶液中都存在电荷守恒和物料守恒,与溶液酸碱性、浓度无关.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
11.下列有关说法正确的是( )
| A. | 含有共价键的晶体一定具有高的熔、沸点及硬度 | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 含阳离子的化合物一定有阴离子 | |
| D. | 空间利用率:面心立方>六方密堆积>体心立方 |
18.常温下,取浓度相等的NaOH和HCl溶液,以3:1体积比相混和,所得溶液的pH等于l2,则原溶液的浓度为( )
| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
8.1mol/L的CuSO4溶液是( )
| A. | 溶液中含有1mol CuSO4 | |
| B. | 1L水中加入160g CuSO4 | |
| C. | 1mol CuSO4溶于1mol水中 | |
| D. | 将250g CuSO4•5H2O溶于少量水后再稀释成1000mL |
12.在强碱性的无色透明溶液中,能大量共存的离子组是( )
| A. | Mg2+、Na+、NO3-、Cl- | B. | K+、Ba2+、MnO4-、NO3- | ||
| C. | Na+、K+、CO32-、Cl- | D. | Ba2+、Na+、NO3-、Cl- |
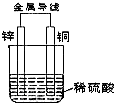 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题: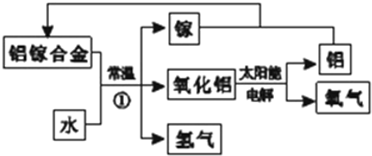 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.