题目内容
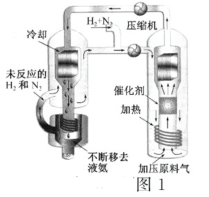
【题目】(一)合成氨工艺(流程如图1所示)是人工固氮最重要的途径。2018年是合成氨工业先驱哈伯(F·Haber)获得诺贝尔奖100周年。
N2和H2生成NH3的反应为:![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)△H(298K)=-46.2kJ·mol-1
NH3(g)△H(298K)=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)![]() 2H*
2H*
表面吸附:N*+H*![]() NH*;NH*+H*
NH*;NH*+H*![]() NH2*;NH2*+H*
NH2*;NH2*+H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)利于提高合成氨平衡产率的条件有_______________
A.低温B.高温C.低压D.高压E.催化剂
(2)标准平衡常数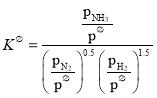 ,其中
,其中![]() 为标准压强1×105Pa,
为标准压强1×105Pa,![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() =
=![]() p,p为平衡总压,
p,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数
为平衡系统中NH3的物质的量分数
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为ω,则![]() =____________(用含ω的最简式表示)
=____________(用含ω的最简式表示)
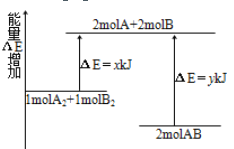
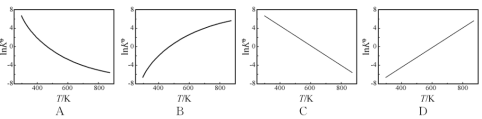
②图中可以示意标准平衡常数K随温度T变化趋势的是____________
(3)实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8
①分析说明原料气中N2过量的理由____________
②关于合成氨工艺的下列理解,正确的是____________
A.合成氨反应在不同温度下的△H和△S都小子零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
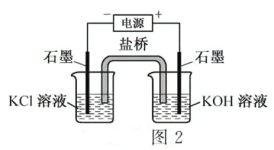
(二)高铁酸钾(K2FeO4)可用作水处理剂口某同学通过“化学一电解法”探究K2FeO4的合成,其原理如图2所示.接通电源,调节电压,将一定量C12通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4
(1)请写出“化学法”得到FeO42一的离子方程式____________
(2)请写出阳极的电极反应式(含FeO42-)____________
【答案】AD ![]() A 原料气中N2相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上吸附是决速步骤,适度过量有利于提高整体反应速率 ADE 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O Fe3++8OH--3e-=FeO42-+4H2O或Fe(OH)3+5OH--3e-=FeO42-+4H2O
A 原料气中N2相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上吸附是决速步骤,适度过量有利于提高整体反应速率 ADE 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O Fe3++8OH--3e-=FeO42-+4H2O或Fe(OH)3+5OH--3e-=FeO42-+4H2O
【解析】
(一)(1)由勒夏特列原理可知,根据反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)△H(298K)=-46.2kJ/mol,为了提高合成氨平衡产率,即平衡正向移动,低温和高压符合条件,故答案为:AD;
NH3(g)△H(298K)=-46.2kJ/mol,为了提高合成氨平衡产率,即平衡正向移动,低温和高压符合条件,故答案为:AD;
(2)①结合题干信息,可建立三段式:

x(NH3)%=![]() ;x(N2)%=
;x(N2)%=![]() ;x(H2)%=
;x(H2)%=![]()
 ,化简得
,化简得![]() ,故答案为:
,故答案为:![]() ;
;
②反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) △H(298K)=-46.2kJ/mol为放热反应,温度T升高,平衡向逆反应方向移动,K0减小,InK0也减小,InK0与温度不成正比,故答案为:A;
NH3(g) △H(298K)=-46.2kJ/mol为放热反应,温度T升高,平衡向逆反应方向移动,K0减小,InK0也减小,InK0与温度不成正比,故答案为:A;
(3)①由反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)可知,加过量氮气,有利于平衡正向移动,提高H2的转化率以及氨气的产率,同时根据题干“N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。”可知,N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率,故答案为:原料气中N2相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上吸附是决速步骤,适度过量有利于提高整体反应速率;
NH3(g)可知,加过量氮气,有利于平衡正向移动,提高H2的转化率以及氨气的产率,同时根据题干“N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。”可知,N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率,故答案为:原料气中N2相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上吸附是决速步骤,适度过量有利于提高整体反应速率;
②A. 由合成氨的反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) △H(298K)=-46.2kJ/mol可知,该反应的气体含量减少,混乱程度降低,即△S小于零,A正确;
NH3(g) △H(298K)=-46.2kJ/mol可知,该反应的气体含量减少,混乱程度降低,即△S小于零,A正确;
B.控制温度远高于室温是为了保证催化剂的活性,提高反应速率,并非为了保证尽可能高的平衡转化率和快的反应速率,B错误;
C.恒压条件充入少量惰性气体,相当于减压,平衡逆向移动,不利于提高平衡转化率,C错误;
D.不断将氨气液化,生成物浓度降低,有利于平衡正向移动,D正确;
E.通过天然气和水蒸气转化制得的H2,由于含有CH4,CO等易燃易爆气体,容易出现安全隐患,此外CH4,CO可能会与催化剂反应,造成催化剂活性降低,所以必须经过净化处理,E正确;
故答案为:ADE;
(二)(1)将一定量C12通入KOH溶液,生成KCl和KClO,KClO具有强氧化性,将Fe3+氧化为FeO42-,然后根据碱性环境,配平即可,得到2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(2)阳极失电子,反应物为Fe3+产物为FeO42-,然后根据碱性环境及守恒规则,易写出Fe3++8OH--3e-=FeO42-+4H2O或Fe(OH)3+5OH--3e-=FeO42-+4H2O,故答案为:Fe3++8OH--3e-=FeO42-+4H2O或Fe(OH)3+5OH--3e-=FeO42-+4H2O。

 阅读快车系列答案
阅读快车系列答案