题目内容
【题目】常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与微粒浓度变化的关系如图所示,下列有关说法错误的是

A. 曲线M表示lg![]() 与pH的变化关系
与pH的变化关系
B. Ka2(H2Y)=10-4.3
C. d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D. 交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
【答案】D
【解析】A、H2Y与KOH发生反应:H2Y+KOH=KHY+H2O、KHY+KOH=K2Y+H2O,随着氢氧化钠溶液,c(HY-)/c(H2Y)逐渐增大,因此曲线M表示lg![]() 与pH的变化关系,故A说法正确;B、当pH=3时,
与pH的变化关系,故A说法正确;B、当pH=3时, ,推出c(Y2-)/c(HY-)=10-1.3,第二步电离平衡常数Ka2=
,推出c(Y2-)/c(HY-)=10-1.3,第二步电离平衡常数Ka2= =10-1.3×10-3=10-4.3,故B说法正确;C、根据电荷守恒,c(K+)+c(H+)=c(OH-)+c(HY-)+2c(Y2-),因此有c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+),故C说法正确;D、e点时,c(HY-)/c(H2Y)=101.5,即c(HY-)>c(H2Y),c(HY-)/c(Y2-)=101.3,c(HY-)>c(Y2-),故D说法错误。
=10-1.3×10-3=10-4.3,故B说法正确;C、根据电荷守恒,c(K+)+c(H+)=c(OH-)+c(HY-)+2c(Y2-),因此有c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+),故C说法正确;D、e点时,c(HY-)/c(H2Y)=101.5,即c(HY-)>c(H2Y),c(HY-)/c(Y2-)=101.3,c(HY-)>c(Y2-),故D说法错误。

【题目】已知H2CO3和H2SO3的电离常数如下表:
酸 | Ka1 | Ka2 |
H2CO3 | 4.27×10-7 | 5.61×10-11 |
H2SO3 | 1.54×10-2 | 1.02×10-7 |
向10mL0.1mol/LNa2CO3溶液中滴加0.1mol/LH2SO3溶液,测得溶液pH随加入H2SO3溶液体积的变化如图所示。
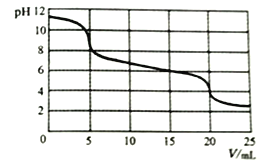
下列说法不正确的是
A. 加入H2SO3溶液前,Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
B. 0<V<5时,溶液中反应为:H2SO3+CO32-==HCO3-+HSO3-
C. 15<V<20时,溶液中反应为:H2SO3+HCO3-==HSO3-+CO2↑+H2O
D. V=15时,所得溶液中:(HCO3-)<c(HSO3-)